Forskere finder ny form for hydrofobe molekyler i vand

Kredit:CC0 Public Domain
Indlejringen af hydrofobe molekyler i vand ser helt anderledes ud end tidligere antaget. I vand, hydrofobe molekyler er omgivet af to forskellige vandpopulationer:den indre skal danner et todimensionelt netværk af vandmolekyler. Det næste lag er dannet af en anden vandpopulation, der er næsten bulkagtig, men danner lidt stærkere hydrogenbindinger til bulkvandet. Den hidtidige antagelse var, at tetraedrisk, "is-lignende" vand dominerer i den inderste hydreringsskal af hydrofobe molekyler. Det modsatte er tilfældet. Disse nye resultater blev offentliggjort af holdet ledet af professor Martina Havenith, formand for Fysisk Kemi II ved Ruhr-Universität Bochum (RUB) i Journal of Physical Chemistry Letters den 18. juni 2020.
Indsigt ved THz-spektroskopi og simuleringer
I deres undersøgelse, forskerne undersøgte hydrogenbindingsnetværket omkring den hydrofobe solvatiserede alkohol tert-butanol, som forskere bruger alkoholer som en prototype modeller for hydrofobe molekyler. Holdet kombinerede resultater fra terahertz (THz) spektroskopi og simuleringer.
I THz-spektroskopi, forskere måler absorptionen af THz-stråling i en prøve. Absorptionsspektret giver et fingeraftryk af vandnettet.
De fik et detaljeret billede af vandlagene, der omgiver molekylet. "Vi omtaler det inderste lag som HB-wrap, hvor HB står for vand-hydrogenbinding, " forklarer Martina Havenith. Det øverste lag kaldes HB-hydration2bulk, som den beskriver grænsefladen til bulkvandet. Kombineret, begge lag af belægningen er nogle gange ikke tykkere end et enkelt lag af vandmolekyler. "Lejlighedsvis, et enkelt vandmolekyle kan være en del af begge lag."
Det indre lag er længere stabilt
Når temperaturen øges, det ydre lag smelter først, og HP-indpakningslaget forbliver længere intakt. "Det indre lag har også mindre frihed til at danne forskellige konfigurationer på grund af det opløste stofs hydrofobicitet, " siger Havenith. "Da individuelle vandmolekyler altid skal vende sig væk fra alkoholen, de danner en todimensionel, løst netværk." Vandmolekyler i det ydre lag har mere frihed til at bevæge sig og derfor også flere muligheder for at forbinde med andre vandmolekyler; forskere omtaler dette fænomen som større entropi.
Denne type interaktion er relevant for foldningsprocesserne af proteiner såvel som biomolekylær genkendelse mellem et lægemiddel og dets målmolekyle. At forstå vandets rolle spiller en afgørende rolle i processen.
Sidste artikelBiomolekyle metal-organiske hybrider med høj bioaktivitet
Næste artikelEt nyt antibiotisk bindingssted fundet i ribosomet
 Varme artikler
Varme artikler
-
 Retsmedicinere låser op for unikke kemiske signaturer i dækTeamet fra University of Central Florida brugte laserinduceret nedbrydningsspektroskopi (LIBS) på hver prøve. Teknikken fokuserer en laser på dækprøven, som skaber et mikroskopisk plasma, der udsender
Retsmedicinere låser op for unikke kemiske signaturer i dækTeamet fra University of Central Florida brugte laserinduceret nedbrydningsspektroskopi (LIBS) på hver prøve. Teknikken fokuserer en laser på dækprøven, som skaber et mikroskopisk plasma, der udsender -
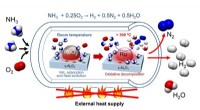 Katalysator til kulstoffri produktion af brintgas fra ammoniakKredit:Katsutoshi Nagaoka (Phys.org)—Hydrogen har potentialet til at give et alternativ, ren energikilde, især når det gælder brændselscelleteknologi. Nuværende brændstofkilder involverer kulstofh
Katalysator til kulstoffri produktion af brintgas fra ammoniakKredit:Katsutoshi Nagaoka (Phys.org)—Hydrogen har potentialet til at give et alternativ, ren energikilde, især når det gælder brændselscelleteknologi. Nuværende brændstofkilder involverer kulstofh -
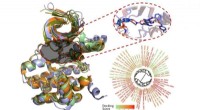 Computermodellering af WNK-kinasehæmmere kunne tilbyde nye værktøjer til at forstå hypertensionKredit:North Carolina State University Forskere fra North Carolina State University har modelleret og analyseret bindingsmåderne for 210 molekyler, der tidligere er rapporteret at hæmme funktionen
Computermodellering af WNK-kinasehæmmere kunne tilbyde nye værktøjer til at forstå hypertensionKredit:North Carolina State University Forskere fra North Carolina State University har modelleret og analyseret bindingsmåderne for 210 molekyler, der tidligere er rapporteret at hæmme funktionen -
 Forskning peger på en anden chance for afvist antibiotikakandidatKredit:University of Leeds En antibiotikakandidatforbindelse, der blev lagt på hylden i 1970erne til fordel for mere lovende lægemidler, kunne være et ekstra kig værd, ny forskning har fundet. St
Forskning peger på en anden chance for afvist antibiotikakandidatKredit:University of Leeds En antibiotikakandidatforbindelse, der blev lagt på hylden i 1970erne til fordel for mere lovende lægemidler, kunne være et ekstra kig værd, ny forskning har fundet. St
- Sådan beregnes lydstyrkeændring
- Var der nogen advarselsskilte inden udbruddet af Saint Helens i 1980?
- Bioinspirerede materialer fra mælkebøtter
- Geologiske og geografiske karakteristika for guldminer
- Afkodning af engagement på sociale medier med berømtheder
- OSIRIS-REx rumfartøj indsamler store prøver af asteroide overflademateriale, NASA bekræfter


