Et nyt antibiotisk bindingssted fundet i ribosomet
Kredit:CC0 Public Domain
En gruppe videnskabsmænd fra Rusland, Tyskland og USA, ledet af Skoltech-forskerne Ilya Osterman, Petr Sergiev, Olga Dontsova og Daniel Wilson fra Hamborg Universitet, har undersøgt den mekanisme, hvorved tetracenomycin X virker, blokering af proteinsynteseprocessen i bakterier. De fandt ud af, at det virker anderledes end det velkendte antibiotikum tetracyclin, som giver gode muligheder for at overvinde antibiotikaresistens hos bakterier.
Bakteriers resistens over for antibiotika er et af hovedproblemerne i moderne medicin og sundhedsvæsen. Konfrontationen mellem bakterier og antibiotikaudviklere er som et våbenkapløb, hvor folk næsten ikke holder trit med mikroskopiske parasitter. Mange traditionelle antibiotika er allerede ineffektive mod nye bakteriestammer, så forskerne er nødt til at finde på noget nyt. Virkningen af antibiotika er normalt rettet mod at blokere de vigtigste processer af bakteriel aktivitet:Syntese af nukleinsyrer, proteiner og cellevægge. Nye antibiotika ligner normalt deres forgængere, så før eller siden, bakterier finder våben mod dem.
Aromatiske polyketider er en af de mest berømte grupper af antibiotika, som omfatter tetracykliner, opdaget i midten af det 20. århundrede, sammen med penicilliner, meget brugt i medicin.
Tetracenomycin er medlem af en relativt ny gruppe af aromatiske polyketider. Tidligere, man troede, at de trænger ind i bakterielt DNA og forårsager replikationsforstyrrelser (fordobling af DNA under celledeling). Imidlertid, forskere fra Skoltech Center for Life Sciences, sammen med kolleger fra Moscow State University og University of Hamburg, har fundet ud af, at en af repræsentanterne for denne familie, tetracenomycin X, blokerer proteinsyntese; i øvrigt, det binder sig ikke til den lille underenhed af ribosomet, som tetracyklin, men til den store.
"Ved brug af kryo-elektronmikroskopi, det var muligt at bestemme bindingsstedet for tetracycinomycin X til ribosomet, det er placeret i tunnelen, hvorigennem det syntetiserede peptid forlader ribosomet, modsat det sted, hvor de velkendte proteinsyntesehæmmere - makrolider og steptograminer B - binder, " siger Skoltech-hovedforsker Ilya Osterman.
Resultaterne indikerer, at tetracenomycin X ikke har krydsresistens med allerede kendte inhibitorer af proteinsyntese, så bakteriestammer vil ikke være resistente over for det.
Det nye strukturelle motiv af proteinsyntesehæmmeren og det nye antibiotikumbindingssted på ribosomet kan være nyttigt til udvikling af nye antibakterielle lægemidler.
Undersøgelsen er publiceret i Naturens kemiske biologi .
 Varme artikler
Varme artikler
-
 Ny bakterietestmetode til at forbedre sundhedsplejen, fødevaresikkerhed og meget mereKredit:Unsplash/CC0 Public Domain Påvisning af levedygtige bakterier er vigtigt for forskellige områder, fra fødevaresikkerhed til medicinsk diagnose. De eksisterende teknikker til at udføre antib
Ny bakterietestmetode til at forbedre sundhedsplejen, fødevaresikkerhed og meget mereKredit:Unsplash/CC0 Public Domain Påvisning af levedygtige bakterier er vigtigt for forskellige områder, fra fødevaresikkerhed til medicinsk diagnose. De eksisterende teknikker til at udføre antib -
 Fremtidens MOF'er:Konvertering af krystallinske metal-organiske rammer til glas eller væskeKrystallinske MOFer bliver nu omdannet til glas/flydende tilstande, åbne nye applikationer. Kredit:Mindy Takamiya Metal-organiske rammer (MOFer) er porøse, krystallinske materialer, der kan fange
Fremtidens MOF'er:Konvertering af krystallinske metal-organiske rammer til glas eller væskeKrystallinske MOFer bliver nu omdannet til glas/flydende tilstande, åbne nye applikationer. Kredit:Mindy Takamiya Metal-organiske rammer (MOFer) er porøse, krystallinske materialer, der kan fange -
 Lys på effektivitetstab i organiske solcellerVed hjælp af en kompleks laseropsætning, holdet opdagede, at i modsætning til de seneste rapporter, betydelige ioniseringsenergiforskydninger var nødvendige for at generere ladninger. Kredit:© 2020 KA
Lys på effektivitetstab i organiske solcellerVed hjælp af en kompleks laseropsætning, holdet opdagede, at i modsætning til de seneste rapporter, betydelige ioniseringsenergiforskydninger var nødvendige for at generere ladninger. Kredit:© 2020 KA -
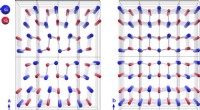 Højeffektive termoelektriske materialer:Ny indsigt i tinselenidSnSe er en meget lagdelt ortorhombisk struktur. SnSe gennemgår en faseovergang af anden orden ved 500°C med en forøgelse af krystalsymmetrien fra rumgruppen Pnma (venstre) til Cmcm (højre). Kredit:HZB
Højeffektive termoelektriske materialer:Ny indsigt i tinselenidSnSe er en meget lagdelt ortorhombisk struktur. SnSe gennemgår en faseovergang af anden orden ved 500°C med en forøgelse af krystalsymmetrien fra rumgruppen Pnma (venstre) til Cmcm (højre). Kredit:HZB
- For at overtale en modstander, prøv at lytte, Berkeley-forsker siger
- Google forbyder annoncer for uprøvede behandlinger, herunder stamceller
- COVID-19 bekræfter forskningen:Musik bringer mennesker sammen (socialt og virtuelt)
- Undersøgelse viser, at en meget billigere katalysator kan generere brint i en kommerciel enhed
- Dark web-undersøgelse afslører, hvordan nye lovovertrædere bliver involveret i online pædofile f…
- Sahara støvtæpper Caribien, luftkvalitet farlig


