Hvad er det frysepunkt for ammoniumsulfat?
* frysningspunktdepression: Frysningspunktet for en opløsning er lavere end frysningspunktet for det rene opløsningsmiddel. Dette skyldes, at de opløste opløste opløste partikler forstyrrer dannelsen af opløsningsmidlets krystalstruktur.
* Koncentration: Depressionen af frysepunktet afhænger af koncentrationen af opløstelsen. Jo højere koncentration af ammoniumsulfat i vand er, jo lavere vil frysepunktet være.
For at bestemme frysepunktet for en ammoniumsulfatopløsning skal du kende koncentrationen af opløsningen.
Her er nogle generelle punkter at huske på:
* Pure vand fryser ved 0 ° C (32 ° F).
* En mættet ammoniumsulfatopløsning ved stuetemperatur er ca. 38% efter vægt. Denne opløsning ville have et markant lavere frysepunkt end rent vand.
M
Sidste artikelHvad er forskellen mellem jernatom og et natriumatom?
Næste artikelEr sukker mere opløseligt end kobbersulfat?
 Varme artikler
Varme artikler
-
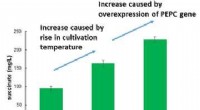 Verdens mest effektive produktion af succinat fra kuldioxidFigur 1:Øgede mængder succinat produceres baseret på overekspression af PEPC -gener og forhøjelse af dyrkningstemperaturen. Kredit:Kobe University Succinat bruges i vid udstrækning som en rå ingre
Verdens mest effektive produktion af succinat fra kuldioxidFigur 1:Øgede mængder succinat produceres baseret på overekspression af PEPC -gener og forhøjelse af dyrkningstemperaturen. Kredit:Kobe University Succinat bruges i vid udstrækning som en rå ingre -
 Billedteknologier øger fokus på gerningsstederKredit:European Cooperation in Science and Technology (COST) Kombinationen af flere billeder og banebrydende teknologi hjælper retsmedicin med at give retshåndhævende myndigheder, juryer og rets
Billedteknologier øger fokus på gerningsstederKredit:European Cooperation in Science and Technology (COST) Kombinationen af flere billeder og banebrydende teknologi hjælper retsmedicin med at give retshåndhævende myndigheder, juryer og rets -
 Forskere udvikler fagocytiske protoceller, der er i stand til målrettet levering af enzymerTidssekvens af optiske mikroskopibilleder, der viser spontan overførsel af et farvestoffyldt tværbundet silicakolloidsom (rød genstand, stiplet linje) ind i en magnetisk emulsionsdråbe gennem en fedts
Forskere udvikler fagocytiske protoceller, der er i stand til målrettet levering af enzymerTidssekvens af optiske mikroskopibilleder, der viser spontan overførsel af et farvestoffyldt tværbundet silicakolloidsom (rød genstand, stiplet linje) ind i en magnetisk emulsionsdråbe gennem en fedts -
 Ny teori kan føre til bedre batterier, brændstofcellerPå dette billede, forskellige farver repræsenterer den krystallografiske orientering af mikrometerstore korn, der udgør et materiale kaldet Yttria Stabilized Zirconia, bruges i brændselsceller og andr
Ny teori kan føre til bedre batterier, brændstofcellerPå dette billede, forskellige farver repræsenterer den krystallografiske orientering af mikrometerstore korn, der udgør et materiale kaldet Yttria Stabilized Zirconia, bruges i brændselsceller og andr
- Feds beslaglægger Backpage.com, websteder i håndhævelse
- Hvilken tektonisk plade er det meste af USA på?
- Hvad kalder du et stof, der kan opdeles i enklere stoffer?
- Ingeniør afslører nyt spin på fremtiden for transistorer med nyt design
- Kunne vi ændre den aksiale hældning?
- Hvad er de elementer, der udgør 96 procent, hvis menneskets krop?


