Er phenol lettere eller vanskeligere at erstatte brom end benzen?
* Elektron-doneringsgruppe: Hydroxyl (-OH) -gruppen i phenol er en elektron-donerende gruppe. Dette betyder, at det øger elektrondensiteten i benzenringen, hvilket gør den mere modtagelig for elektrofilt angreb.
* Resonansstabilisering: Det ensomme par elektroner på oxygenatomet i hydroxylgruppen kan deltage i resonans med benzenringen, yderligere stigende elektrondensitet og aktivere ringen mod elektrofil substitution.
I modsætning hertil er benzen en relativt ureaktiv aromatisk forbindelse. Det kræver barske forhold og en stærk elektrofil som brom i nærvær af en Lewis -syrekatalysator (som februar) for at gennemgå bromering.
Derfor gennemgår phenol bromination let ved stuetemperatur uden behov for en katalysator. Dette skyldes, at den elektron-donerende hydroxylgruppe aktiverer ringen, hvilket gør den meget mere modtagelig for elektrofilt angreb fra brom.
 Varme artikler
Varme artikler
-
 Ingeniører opdager en ny rolle for vand i produktionen af vedvarende brændstofferOU-ingeniører har opdaget en ny tilgang til vandstøttet opgradering af det vedvarende kemikalie, furfural, fordoble eller tredoble konverteringshastigheden. Kredit:University of Oklahoma Universit
Ingeniører opdager en ny rolle for vand i produktionen af vedvarende brændstofferOU-ingeniører har opdaget en ny tilgang til vandstøttet opgradering af det vedvarende kemikalie, furfural, fordoble eller tredoble konverteringshastigheden. Kredit:University of Oklahoma Universit -
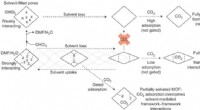 Kontinuerlig åndbar metal-organisk ramme med gæsteselektivitetForeslået rolle for gæst-ramme-interaktioner i de opløsningsmiddelafhængige kontinuerlige vejrtrækningsegenskaber af SHF-61. Kredit:(c) Naturkemi (2017). DOI:10.1038/nchem.2747 (Phys.org) —Forsk
Kontinuerlig åndbar metal-organisk ramme med gæsteselektivitetForeslået rolle for gæst-ramme-interaktioner i de opløsningsmiddelafhængige kontinuerlige vejrtrækningsegenskaber af SHF-61. Kredit:(c) Naturkemi (2017). DOI:10.1038/nchem.2747 (Phys.org) —Forsk -
 Video:Popping balloner med stilKredit:The American Chemical Society Appelsinskræller indeholder limonen, og dette kemikalie er nøglen til et festtrick, hvor du kan springe en ballon med et twist. Limonene er et usædvanligt god
Video:Popping balloner med stilKredit:The American Chemical Society Appelsinskræller indeholder limonen, og dette kemikalie er nøglen til et festtrick, hvor du kan springe en ballon med et twist. Limonene er et usædvanligt god -
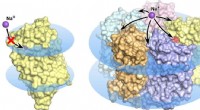 Biofysikere løser den sande struktur af meget lovende optogenetisk protein KR2 rhodopsinKR2 rhodopsin monomer (venstre) og pentamer (højre) i cellemembranen, vist som blå diske. I monomer tilstand, natriumtransport er blokeret, den orange pore tillader ikke ionoptagelse i proteinet. Kred
Biofysikere løser den sande struktur af meget lovende optogenetisk protein KR2 rhodopsinKR2 rhodopsin monomer (venstre) og pentamer (højre) i cellemembranen, vist som blå diske. I monomer tilstand, natriumtransport er blokeret, den orange pore tillader ikke ionoptagelse i proteinet. Kred
- Hvem var opfinderen af X Ray Telescope?
- Hvordan virker en propanregulator?
- Hvad hedder den første del af Geography -bogen?
- Hvor mange ounces i 100 gram?
- Hvordan påvirker ændringer i lufttemperatur vand væsken og gastilstandene?
- Hvis kalksten blev knust, hvad ville det gøre med reaktionshastigheden mellem en syre og kalksten?


