Hvorfor gør syrer og baser gode elektriske ledere, når de opløses i vand?
* syrer: Når syrer opløses i vand, frigiver de hydrogenioner (H+) og en negativt ladet anion.
* Eksempel:Hydrochlorsyre (HCI) dissocieres i H+ og Cl- ioner.
* baser: Når baser opløses i vand, frigiver de hydroxidioner (OH-) og en positivt ladet kation.
* Eksempel:Natriumhydroxid (NaOH) dissocieres i Na+ og OH-ioner.
hvordan ioner udfører elektricitet:
* Frit bevægende afgifter: Tilstedeværelsen af disse frie ioner i opløsning muliggør strøm af elektrisk strøm. Når der anvendes et elektrisk potentiale, bevæger de positivt ladede ioner sig mod den negative elektrode (katode), og de negativt ladede ioner bevæger sig mod den positive elektrode (anode).
* ionisk bevægelse: Denne bevægelse af ioner udgør en elektrisk strøm, hvilket gør løsningen til en god leder.
Vigtige noter:
* Konduktivitetsstyrke: Konduktiviteten af en syre- eller basisopløsning afhænger af koncentrationen af ioner, der er til stede. En højere koncentration af ioner fører til bedre ledningsevne.
* Vandets rolle: Vand spiller en afgørende rolle i denne proces. Det fungerer som et opløsningsmiddel, hvilket gør det muligt for syre- eller basismolekylerne at adskille sig i ioner.
Kortfattet: Evnen hos syrer og baser til at dissociere i ioner, når de opløses i vand, er den nøglefaktor, der gør dem til gode elektriske ledere. Den frie bevægelse af disse ioner muliggør strøm af elektrisk strøm.
Sidste artikelHvor mange atomer i 12 gram kulstof?
Næste artikelOpløses aluminiumacetat i vand?
 Varme artikler
Varme artikler
-
 Sølvforing til ekstrem elektronikMSU-forskere udviklede en proces til at skabe mere modstandsdygtige kredsløb, hvilket de demonstrerede ved at skabe en sølvfarvet spartansk hjelm. Kredsløbet er designet af Jane Manfredi, en adjunkt v
Sølvforing til ekstrem elektronikMSU-forskere udviklede en proces til at skabe mere modstandsdygtige kredsløb, hvilket de demonstrerede ved at skabe en sølvfarvet spartansk hjelm. Kredsløbet er designet af Jane Manfredi, en adjunkt v -
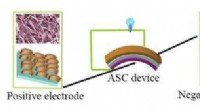 FeCo-selenid - et muligt næste generations materiale til energilagringsenhederDet skematiske fremstillingsdiagram af FeCo-selenid//Fe 2 O 3 asymmetrisk superkondensator (ASC). FeCo-seleniden og Fe 2 O 3 elektroder fungerer som henholdsvis positive og negative elektroder
FeCo-selenid - et muligt næste generations materiale til energilagringsenhederDet skematiske fremstillingsdiagram af FeCo-selenid//Fe 2 O 3 asymmetrisk superkondensator (ASC). FeCo-seleniden og Fe 2 O 3 elektroder fungerer som henholdsvis positive og negative elektroder -
 Forskere udvikler Venus fluefanger bio-sensorer for at fange forurenende stofferForskningen præsenteres som et hot paper og er også udvalgt som tidsskriftets forsideillustration. Kredit:Wiley Forskere fra Trinity har skabt en række nye biologiske sensorer ved kemisk at ombygg
Forskere udvikler Venus fluefanger bio-sensorer for at fange forurenende stofferForskningen præsenteres som et hot paper og er også udvalgt som tidsskriftets forsideillustration. Kredit:Wiley Forskere fra Trinity har skabt en række nye biologiske sensorer ved kemisk at ombygg -
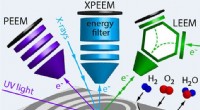 Tre mikroskoper ser mere end toGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.2c03692 Man skal se meget nøje for at forstå, hvilke processer der finder sted på overfladerne af katalysatorer. Faste katalysato
Tre mikroskoper ser mere end toGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.2c03692 Man skal se meget nøje for at forstå, hvilke processer der finder sted på overfladerne af katalysatorer. Faste katalysato
- Kemikere udvikler hydrogelstrenge ved hjælp af forbindelse fundet i havdyr
- Sådan beregnes kardinalitet
- Hvilken retning stiger solen på månen?
- Hvilken bjergkæde dannede sig, da pladen indeholdende indisk subkontinent bombede til kontinentet i…
- NASA opsender babyblæksprutter og vandbjørne til den internationale rumstation
- Spørgsmål og svar:La Ninas er tilbage, og det er ikke godt for dele af det tørre vest


