Hvorfor bruges præfikser til navngivning af kovalente forbindelser?
Her er hvorfor præfikser er nødvendige, og hvordan de fungerer:
* klarhed og specificitet: Uden præfikser ville det være umuligt at skelne mellem forskellige kovalente forbindelser med varierende antal atomer. For eksempel er CO og CO2 begge forbindelser af kulstof og ilt, men de har meget forskellige egenskaber og formler. Præfikser som "mono-" og "di-" tillader os klart at identificere disse forbindelser som henholdsvis kulilte og kuldioxid.
* Konsistens og standardisering: Præfikser tilvejebringer et standardiseret system til navngivning af kovalente forbindelser. Dette gør det lettere for kemikere at kommunikere og forstå hinanden.
* Forståelse af molekylstrukturen: Præfiksen i en kovalent forbindelses navn svarer direkte til antallet af atomer i molekylet. Dette hjælper med at visualisere strukturen og forstå bindingen i forbindelsen.
Her er en sammenbrud af de fælles præfikser, der bruges i kovalent sammensat nomenklatur:
| Præfiks | Nummer |
| --- | --- |
| Mono- | 1 |
| Di- | 2 |
| Tri- | 3 |
| Tetra- | 4 |
| Penta- | 5 |
| Hexa- | 6 |
| Hepta- | 7 |
| Octa- | 8 |
| Nona- | 9 |
| Deca- | 10 |
Eksempler:
* CO2: Kuldioxid (di-indikerer to iltatomer)
* N2O4: Dinitrogen tetroxid (di-indikerer to nitrogenatomer, tetra- angiver fire iltatomer)
* pcl5: Phosphor pentachlorid (penta- angiver fem kloratomer)
Afslutningsvis er præfikser vigtige for at navngive kovalente forbindelser, fordi de giver klarhed, konsistens og en direkte repræsentation af molekylstrukturen.
 Varme artikler
Varme artikler
-
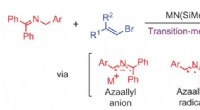 Overgangsmetalfri carbon-carbon-bindingsdannende reaktion:vinylering af azaallylOvergangs-metal-fri vinylering af azaallyl-anioner. Kredit:(c) Naturkemi (2017). DOI:10.1038/nchem.2760 (Phys.org) - Visse funktionelle grupper viser sig ofte i naturlige produkter og biologisk
Overgangsmetalfri carbon-carbon-bindingsdannende reaktion:vinylering af azaallylOvergangs-metal-fri vinylering af azaallyl-anioner. Kredit:(c) Naturkemi (2017). DOI:10.1038/nchem.2760 (Phys.org) - Visse funktionelle grupper viser sig ofte i naturlige produkter og biologisk -
 Bioinspirerede materialer-lån fra naturens legebogEt skibsskelet af havsvamp, der viser den komplekse karakter af dets struktur, som giver fantastisk styrke. Kredit:Michael Monn, Kesari Lab, Brown University Naturen giver utallige eksempler på un
Bioinspirerede materialer-lån fra naturens legebogEt skibsskelet af havsvamp, der viser den komplekse karakter af dets struktur, som giver fantastisk styrke. Kredit:Michael Monn, Kesari Lab, Brown University Naturen giver utallige eksempler på un -
 Forskere afslører, hvordan MRSA-bakterien håndterer stressEt internationalt hold af forskere har afsløret en grundlæggende mekanisme, der er ansvarlig for at håndtere stress hos stafylokokker, når de udsættes for antibiotika. Kredit:Ditlev E. Brodersen E
Forskere afslører, hvordan MRSA-bakterien håndterer stressEt internationalt hold af forskere har afsløret en grundlæggende mekanisme, der er ansvarlig for at håndtere stress hos stafylokokker, når de udsættes for antibiotika. Kredit:Ditlev E. Brodersen E -
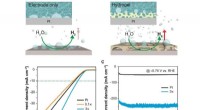 Superaerofobiske hydrogeler til forbedret elektrokemisk og fotoelektrokemisk brintproduktionEffekt af det superaerofobiske hydrogeloverlag på ydeevnen af Pt-elektroder i hydrogenudviklingsreaktioner (HER). Kredit:Professor Jungki Ryu, UNIST En nylig undersøgelse, tilknyttet Sydkoreas U
Superaerofobiske hydrogeler til forbedret elektrokemisk og fotoelektrokemisk brintproduktionEffekt af det superaerofobiske hydrogeloverlag på ydeevnen af Pt-elektroder i hydrogenudviklingsreaktioner (HER). Kredit:Professor Jungki Ryu, UNIST En nylig undersøgelse, tilknyttet Sydkoreas U
- Overfyldte kratersøer huggede kløfter hen over Mars
- En bølge i et reb er tværgående, men lyd en bølge?
- Hvorfor kan strømmen af vand og aflejringssediment rock, der efterlader være nyttig for forskere…
- Solar geoengineering for at afkøle planeten:Er det risiciene værd?
- Hvordan teenagere bruger falske Instagram-konti til at lette presset af perfektion
- Undersøgelse finder strategi til at komme sig efter afbrydelser på arbejdet


