Beskriv et stof, der reagerer med både syrer og alkalier for at danne saltvand?
Her er hvorfor:
* amfoteriske oxider er metaloxider, der kan fungere som både syrer og baser.
* syrer Doner hydrogenioner (H+) i opløsning.
* alkalis er baser, der donerer hydroxidioner (OH-) i opløsning.
reaktion med syrer:
Når en amfoterisk oxid reagerer med en syre, fungerer det som en base og accepterer brintioner til dannelse af et salt og vand.
Eksempel:
Aluminiumoxid (AL2O3) reagerer med saltsyre (HCI):
AL2O3 (S) + 6HCl (aq) → 2Alcl3 (aq) + 3H2O (l)
Her er aluminiumchlorid (ALCL3) det dannede salt.
reaktion med alkalier:
Når en amfoterisk oxid reagerer med en alkali, fungerer det som en syre, der donerer oxidioner (O2-) for at danne et salt og vand.
Eksempel:
Aluminiumoxid (AL2O3) reagerer med natriumhydroxid (NaOH):
AL2O3 (S) + 2NAOH (AQ) + 3H2O (L) → 2NAAL (OH) 4 (AQ)
Her er natriumaluminat (Naal (OH) 4) den dannede salt.
Almindelige eksempler på amfoteriske oxider:
* Aluminiumoxid (AL2O3)
* Zinkoxid (Zno)
* Leadoxid (PBO)
Derfor reagerer amfoteriske oxider som aluminiumoxid med både syrer og alkalier for at danne saltvand (og et andet salt).
Sidste artikelNår H2S brænder, konverteres det, i hvilken gas?
Næste artikelHvorfor er klor mere reaktiv end argon?
 Varme artikler
Varme artikler
-
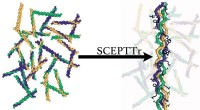 Kollagenstrukturer får den kongelige afsløringEn algoritme af forskere fra Rice University forudsiger strukturer og smeltetemperaturer af kollagen, den tredobbelte spiral, der tegner sig for omkring en tredjedel af kroppens proteiner og danner fi
Kollagenstrukturer får den kongelige afsløringEn algoritme af forskere fra Rice University forudsiger strukturer og smeltetemperaturer af kollagen, den tredobbelte spiral, der tegner sig for omkring en tredjedel af kroppens proteiner og danner fi -
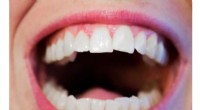 Afkodning af de grundlæggende mekanismer for menneskelig spytsmøringKredit:CC0 Public Domain Et tværfagligt team af forskere ledet af University of Leeds har afsløret den grundlæggende mekanisme, hvorved menneskets spyt smører vores mund. Deres multi-skala undersø
Afkodning af de grundlæggende mekanismer for menneskelig spytsmøringKredit:CC0 Public Domain Et tværfagligt team af forskere ledet af University of Leeds har afsløret den grundlæggende mekanisme, hvorved menneskets spyt smører vores mund. Deres multi-skala undersø -
 Forskere opfinder dyrefri test af dødelige neurotoksinerEn tempelgravhugorm fra Gombak-dalen, Malaysia. Kredit:Scientistchic Dyreforsøg vil ikke længere være påkrævet for at vurdere en gruppe dødelige neurotoksiner, takket være University of Queensland
Forskere opfinder dyrefri test af dødelige neurotoksinerEn tempelgravhugorm fra Gombak-dalen, Malaysia. Kredit:Scientistchic Dyreforsøg vil ikke længere være påkrævet for at vurdere en gruppe dødelige neurotoksiner, takket være University of Queensland -
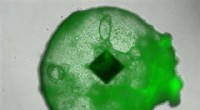 Forskere bruger RFID -chips til at spore biologiske prøverEn menneskelig leverorganoid med en indlejret RFID-mikrochip. Kredit:Kimura et al./iScience Radio frequency identification (RFID) chips bruges i dag til alt fra betaling for offentlig transport ti
Forskere bruger RFID -chips til at spore biologiske prøverEn menneskelig leverorganoid med en indlejret RFID-mikrochip. Kredit:Kimura et al./iScience Radio frequency identification (RFID) chips bruges i dag til alt fra betaling for offentlig transport ti
- Hvad inkluderer naturen?
- Antibakterielle sølvnanopartikler er en eksplosion
- Sådan læses en Refractometer
- Hvad sker der med potentiel energi, når rock falder?
- Hvorfor fejler nogle organisationers bestyrelser? Det kan være, hvordan direktører opfatter deres …
- Hvordan Amazon overbeviste dig om at betale for shopping


