Hvilket stof ændrer hastigheden for en kemisk reaktion uden at ændre sig selv?
Her er en sammenbrud:
* katalysator: Et stof, der fremskynder en kemisk reaktion uden at blive konsumeret i processen. Det giver en alternativ vej til reaktionen med en lavere aktiveringsenergi.
* Aktiveringsenergi: Den minimale energi, der kræves for at en reaktion kan forekomme.
Hvordan katalysatorer fungerer:
Katalysatorer fungerer ved at tilvejebringe en alternativ reaktionsvej med en lavere aktiveringsenergi. Dette betyder, at flere molekyler har nok energi til at reagere, hvilket fører til en hurtigere reaktionshastighed.
Eksempler på katalysatorer:
* enzymer: Biologiske katalysatorer, der letter biokemiske reaktioner i levende organismer.
* Metaller: Metaller som platin og palladium bruges som katalysatorer i forskellige industrielle processer.
* syrer: Syrer som svovlsyre kan fungere som katalysatorer i nogle reaktioner.
Nøglepunkt: Katalysatorer ændrer ikke reaktionens ligevægtsposition; De fremskynder kun den hastighed, hvormed ligevægt er nået.
 Varme artikler
Varme artikler
-
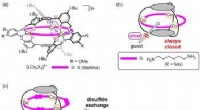 Et lukket burlignende molekyle, der kan åbnesFig.1 Oprindeligt lukket molekylærbur (til venstre). Disulfidbindinger kan brydes via reaktioner med thiolatanioner, resulterer i dannelse af åbninger (højre). Kredit:Kanazawa University Forskere
Et lukket burlignende molekyle, der kan åbnesFig.1 Oprindeligt lukket molekylærbur (til venstre). Disulfidbindinger kan brydes via reaktioner med thiolatanioner, resulterer i dannelse af åbninger (højre). Kredit:Kanazawa University Forskere -
 Forudsiger friktionsgrænser:Team ser på materialets egenskaberSandia National Laboratories forskere Michael Chandross, venstre, og Nicolas Argibay viser en computersimulering og et ultrahøjt vakuumtribometer, der bruges til friktions- og slidprøvning, som er bla
Forudsiger friktionsgrænser:Team ser på materialets egenskaberSandia National Laboratories forskere Michael Chandross, venstre, og Nicolas Argibay viser en computersimulering og et ultrahøjt vakuumtribometer, der bruges til friktions- og slidprøvning, som er bla -
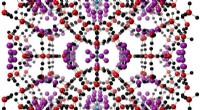 CO2 clathrate hydrat egenskaberFigur 1:Krystalstruktur af et CO2-klatrathydrat. Burstrukturen er dannet ud fra interaktionen af CO2-gas med vandmolekyler i is (rød og sort:ilt- og brintatomer, henholdsvis). CO2-molekyler (blå og
CO2 clathrate hydrat egenskaberFigur 1:Krystalstruktur af et CO2-klatrathydrat. Burstrukturen er dannet ud fra interaktionen af CO2-gas med vandmolekyler i is (rød og sort:ilt- og brintatomer, henholdsvis). CO2-molekyler (blå og -
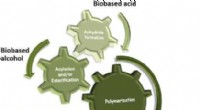 Økonomisk syntese af polyacrylater og polymethacrylater fra biobaserede materialerKredit:Angewandte Chemie På trods af industriens bedste indsats for at arbejde hen imod bæredygtighed, de fleste plastik (eller polymerer) er stadig fremstillet ved hjælp af ikke-fornybare fossile
Økonomisk syntese af polyacrylater og polymethacrylater fra biobaserede materialerKredit:Angewandte Chemie På trods af industriens bedste indsats for at arbejde hen imod bæredygtighed, de fleste plastik (eller polymerer) er stadig fremstillet ved hjælp af ikke-fornybare fossile


