Hvad kombineres med svovl?
Metaller:
* sulfider: Svovl reagerer direkte med de fleste metaller for at danne sulfider. Eksempler inkluderer jernsulfid (FES), blysulfid (PBS) og kviksølvsulfid (HGS).
* Metalsulfater: Mange metaller danner sulfater, som er salte, der indeholder sulfationen (SO₄²⁻). Eksempler inkluderer kobbersulfat (cuso₄), natriumsulfat (Na₂so₄) og magnesiumsulfat (MGSO₄).
ikke -metaller:
* Oxider: Svovl kombineres med ilt for at danne svovldioxid (SO₂) og svovltrioxid (SO₃). Disse oxider er vigtige i dannelsen af surt regn.
* halogenider: Svovl kan reagere med halogener som fluor (F), chlor (CL) og brom (BR) for at danne svovlhalogenider. Eksempler inkluderer svovl hexafluorid (SF₆) og svovldichlorid (SCL₂).
* brint: Svovl reagerer med brint til dannelse af hydrogensulfid (H₂S), en farveløs, giftig gas med en karakteristisk rådnet æg lugt.
Andet:
* carbon: Svovl kan kombineres med carbon til dannelse af carbondisulfid (CS₂), en meget brandfarlig væske, der bruges som opløsningsmiddel.
* nitrogen: Svovl kan kombineres med nitrogen for at danne svovlnitrider, som er forbindelser med en lang række egenskaber.
* fosfor: Svovl kan reagere med fosfor til dannelse af fosforsulfider, der bruges i kampe og fyrværkeri.
Vigtige overvejelser:
* reaktionsbetingelser: De specifikke betingelser (temperatur, tryk, tilstedeværelse af katalysatorer) kan påvirke, hvilke forbindelser der dannes.
* Oxidationstilstand: Oxidationstilstanden af svovl kan variere afhængigt af det element, den kombineres med.
Kombinationerne af svovl er enorme og forskellige, hvilket fører til dannelse af en lang række forbindelser med vigtige anvendelser i forskellige brancher.
 Varme artikler
Varme artikler
-
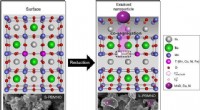 Nye kulbrintebrændselsceller med høj effektivitet og lave omkostningerEkssolution af B-site kation med oxygen fra lagdelt perovskit i en reducerende atmosfære. Kredit:UNIST Sydkoreas Ulsan National Institute of Science and Technology har introduceret nye lave omkost
Nye kulbrintebrændselsceller med høj effektivitet og lave omkostningerEkssolution af B-site kation med oxygen fra lagdelt perovskit i en reducerende atmosfære. Kredit:UNIST Sydkoreas Ulsan National Institute of Science and Technology har introduceret nye lave omkost -
 En grøn tilgang til fremstilling af ammoniak kunne hjælpe med at brødføde verdenKredit:UCF:Karen Norum Et UCF-forskerhold med samarbejdspartnere ved Virginia Tech har udviklet en ny grøn tilgang til fremstilling af ammoniak, der kan hjælpe med at gøre fodring af den stigende
En grøn tilgang til fremstilling af ammoniak kunne hjælpe med at brødføde verdenKredit:UCF:Karen Norum Et UCF-forskerhold med samarbejdspartnere ved Virginia Tech har udviklet en ny grøn tilgang til fremstilling af ammoniak, der kan hjælpe med at gøre fodring af den stigende -
 Højopløsningsstrukturer af archaerhodopsin-3-proteinet kaster nyt lys over receptordesensibiliseri…Krystaller af AR3 observeret under polariseret lys (venstre). Kredit:Copyright til billederne ligger hos forfatterne i henhold til Nature Communications vilkår og betingelser For første gang, et i
Højopløsningsstrukturer af archaerhodopsin-3-proteinet kaster nyt lys over receptordesensibiliseri…Krystaller af AR3 observeret under polariseret lys (venstre). Kredit:Copyright til billederne ligger hos forfatterne i henhold til Nature Communications vilkår og betingelser For første gang, et i -
 Nye fingeraftryk tilføjet til kemisk identifikationsdatabaseNIST -forskningskemiker Kelly Telu injicerer en prøve i et massespektrometer, et laboratorieinstrument, som forskere bruger til at identificere ukendte kemiske forbindelser. Kredit:M. Delorme/NIST
Nye fingeraftryk tilføjet til kemisk identifikationsdatabaseNIST -forskningskemiker Kelly Telu injicerer en prøve i et massespektrometer, et laboratorieinstrument, som forskere bruger til at identificere ukendte kemiske forbindelser. Kredit:M. Delorme/NIST
- Anvendelse af DNA-ekstraktion
- Cytoplasma: Funktion og fakta
- Hvorfor Jupiter ikke har ringe som Saturn
- Hvilken gruppe af levende ting bidrager mest til biogent sediment?
- Kæmper drømmen om ideelle usynlighedskapper til stressbølger
- Ingeniører planlægger at bringe nyt liv til elektronikgenanvendelse, adressere mangler i forsyning…


