Hvad er det ydre elektronarrangement af natrium azid?
1. Identificer ionerne:
* natrium (NA): Natrium mister en elektron til dannelse af en +1 -kation (Na +).
* azid (n3-): Azidionen er en polyatomisk ion med en -1 -ladning.
2. Elektronkonfiguration af ioner:
* Na+: Sodiums elektronkonfiguration er 1S² 2S²2P⁶3S¹. At miste en elektron forlader den med 1S² 2S²2p⁶, som er det samme som neon (NE).
* n3-: Azidionen (N3-) har i alt 16 valenselektroner (3 nitrogenatomer x 5 valenselektroner + 1 ekstra elektron fra den negative ladning). Det mest stabile arrangement er en tredobbelt binding mellem nitrogenatomerne, hvor hver nitrogen har et ensomt par elektroner. Dette giver hvert nitrogenatom i alt 8 elektroner i dets ydre skal.
3. Ydre elektronarrangement af natrium azid:
Da natrium azid er ioniske, overføres natriumkationens ydre elektroner fuldstændigt til azidanionen. Derfor har natriumkation (Na+) ingen ydre elektroner , og azidanionen (N3-) har en komplet ydre skal med 8 elektroner for hvert nitrogenatom .
Kortfattet:
* Natriumkation (Na+) - Ingen ydre elektroner.
* Azid Anion (N3-) - Hvert nitrogenatom har 8 elektroner i sin ydre skal.
 Varme artikler
Varme artikler
-
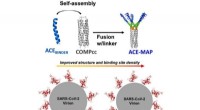 Konstrueret multivalent selvsamlet bindeprotein mod SARS-CoV-2 RBDGrafisk abstrakt. Kredit:Biochemical Engineering Journal (2022). DOI:10.1016/j.bej.2022.108596 Siden den dukkede op i 2019, har COVID-19 krævet over 6 millioner liv og vendt samfundet over hele klo
Konstrueret multivalent selvsamlet bindeprotein mod SARS-CoV-2 RBDGrafisk abstrakt. Kredit:Biochemical Engineering Journal (2022). DOI:10.1016/j.bej.2022.108596 Siden den dukkede op i 2019, har COVID-19 krævet over 6 millioner liv og vendt samfundet over hele klo -
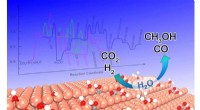 Vand kan modulere aktiviteten og selektiviteten af reduktion af kuldioxidDet skematiske diagram over vandeffekt på CO 2 hydrogenering over trinvis Cu (211) overflade. Kredit:Science China Press Som et alternativ til udtømning af fossile ressourcer, reduktion af CO 2
Vand kan modulere aktiviteten og selektiviteten af reduktion af kuldioxidDet skematiske diagram over vandeffekt på CO 2 hydrogenering over trinvis Cu (211) overflade. Kredit:Science China Press Som et alternativ til udtømning af fossile ressourcer, reduktion af CO 2 -
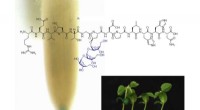 Modificerede peptider kunne booste plantevækst og udviklingNy undersøgelse viser, at peptider kan manipulere plantevækst, fører til højere udbytte. Kredit:Dr Brett Ferguson En ny australsk undersøgelse af peptidhormoner, der er kritiske for planteudviklin
Modificerede peptider kunne booste plantevækst og udviklingNy undersøgelse viser, at peptider kan manipulere plantevækst, fører til højere udbytte. Kredit:Dr Brett Ferguson En ny australsk undersøgelse af peptidhormoner, der er kritiske for planteudviklin -
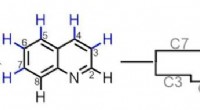 Kemikere opnår molekylær redigeringScripps Research og University of California, Los Angeles, har udviklet metoder til at modificere en bred klasse af kemiske forbindelser, der almindeligvis bruges til at bygge lægemiddelmolekyler. Bil
Kemikere opnår molekylær redigeringScripps Research og University of California, Los Angeles, har udviklet metoder til at modificere en bred klasse af kemiske forbindelser, der almindeligvis bruges til at bygge lægemiddelmolekyler. Bil
- Hvordan hænger lysets frekvens og bølgelængde sammen?
- Ionoptik-baseret kvantemikroskop kan afbilde individuelle atomer
- Hvad er fordelene ved at bruge nuklear som kildeenergi?
- Hvad er en formelenhed, og giv et eksempel?
- En kraft, der holder strømmen flyder?
- Santos-aktierne stiger efter Harbor Energy-overtagelsestilbuddet


