Hvorfor har alkoholer et højere kogepunkt end de ækvivalente alkaner?
Her er hvorfor:
* Hydrogenbinding: Alkoholer indeholder en hydroxylgruppe (-OH). Oxygenatomet i denne gruppe er meget elektronegativ, hvilket betyder, at det tiltrækker elektroner stærkere end brint. Dette skaber en delvis negativ ladning på ilt og en delvis positiv ladning på brint. Denne polaritet muliggør hydrogenbinding mellem alkoholmolekyler.
* stærkere intermolekylære kræfter: Hydrogenbindinger er meget stærkere end van der Waals -kræfterne, der findes mellem alkanmolekyler. Disse stærke kræfter kræver mere energi til at overvinde, hvilket fører til et højere kogepunkt for alkoholer.
* Polaritet: Alkoholer er polære molekyler på grund af tilstedeværelsen af hydroxylgruppen. Denne polaritet bidrager også til stærkere intermolekylære interaktioner mellem alkoholmolekyler, hvilket yderligere øger kogepunktet.
I modsætning:
* Alkaner er ikke -polære molekyler, hvilket betyder, at de kun udviser svage van der Waals -kræfter mellem molekyler. Disse kræfter overvindes let, hvilket resulterer i lavere kogepunkter.
Kortfattet: Tilstedeværelsen af hydrogenbinding og polariteten af hydroxylgruppen i alkoholer øger deres kogepunkter markant sammenlignet med deres alkan -kolleger.
Sidste artikelKemisk formel til natriumdihydrogenphosphatheptahydrat?
Næste artikelHvor mange molekyler er der i 0,65 mol svovldioxid?
 Varme artikler
Varme artikler
-
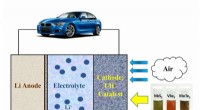 2-D-materialer kan gøre det muligt for elektriske køretøjer at komme 500 miles på en enkelt opla…2D-katalysatorer driver et elektrisk køretøj. Kredit:Amin Salehi-Khojin Lithium-luft-batterier er klar til at blive den næste revolutionerende erstatning for aktuelt brugte lithium-ion-batterier,
2-D-materialer kan gøre det muligt for elektriske køretøjer at komme 500 miles på en enkelt opla…2D-katalysatorer driver et elektrisk køretøj. Kredit:Amin Salehi-Khojin Lithium-luft-batterier er klar til at blive den næste revolutionerende erstatning for aktuelt brugte lithium-ion-batterier, -
 Q&A:Den fascinerende baggrund for det periodiske system, som er ved at fylde 150 årKredit:CC0 Public Domain Det periodiske system er blevet et ikon for videnskab. Dens rækker og søjler giver en pæn måde at fremvise elementerne - ingredienserne, der udgør universet. Det virker i
Q&A:Den fascinerende baggrund for det periodiske system, som er ved at fylde 150 årKredit:CC0 Public Domain Det periodiske system er blevet et ikon for videnskab. Dens rækker og søjler giver en pæn måde at fremvise elementerne - ingredienserne, der udgør universet. Det virker i -
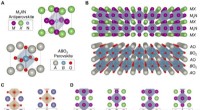 Epitaksiale antiperovskit/perovskite heterostrukturer til materialedesignSkematisk repræsentation af krystalstrukturerne af M3XN nitrid antiperovskite og ABO3 oxid perovskite forbindelser og deres grænseflader. (A) M3XN og ABO3 ideelle enhedsceller, der viser deres geometr
Epitaksiale antiperovskit/perovskite heterostrukturer til materialedesignSkematisk repræsentation af krystalstrukturerne af M3XN nitrid antiperovskite og ABO3 oxid perovskite forbindelser og deres grænseflader. (A) M3XN og ABO3 ideelle enhedsceller, der viser deres geometr -
 Et klæbrigt emne:At studere skaldyr til avancerede klæbemidlerJonathan Wilker, professor i uorganisk kemi, studerer skaldyr for at udvikle klæbemidler, der er mere bæredygtige og stærkere, og arbejde i en bredere vifte af miljøer end nuværende klæbemidler. Kredi
Et klæbrigt emne:At studere skaldyr til avancerede klæbemidlerJonathan Wilker, professor i uorganisk kemi, studerer skaldyr for at udvikle klæbemidler, der er mere bæredygtige og stærkere, og arbejde i en bredere vifte af miljøer end nuværende klæbemidler. Kredi


