Hvorfor Boron laver kovalente bindinger, men ikke ioniske bindinger?
1. lille størrelse og høj ioniseringsenergi: Bor er et meget lille atom med en høj ioniseringsenergi. Dette betyder, at det kræver en masse energi for at fjerne et elektron fra dets ydre skal. Derfor er det energisk ugunstigt for bor at miste elektroner og danne en positiv ion.
2. Elektronegativitet: Bor har en relativt høj elektronegativitet (2,0 på Pauling -skalaen). Dette betyder, at det tiltrækker elektroner stærkt, hvilket gør det mindre sandsynligt, at det mister et elektron fuldstændigt til et andet atom.
3. ufuldstændig octet: Bor har i sin mest almindelige form kun tre valenselektroner. For at opnå en stabil octet (8 elektroner i sin ydre skal) skal boren dele elektroner, ikke helt vinde eller miste dem.
4. obligationsstyrke: Bor danner stærke kovalente bindinger med andre ikke -metaller, såsom ilt, brint og nitrogen. Disse bindinger er stærkere end de ioniske bindinger, den ville danne, hvis det skulle miste elektroner.
Kortfattet:
* Borons lille størrelse, høj ioniseringsenergi og elektronegativitet gør det vanskeligt at danne ioniske bindinger.
* Borons ufuldstændige Octet kræver deling af elektroner, hvilket fører til dannelse af kovalent binding.
* De stærke kovalente bindinger, den danner, er energisk gunstige sammenlignet med ioniske bindinger.
Derfor danner bor primært kovalente bindinger for at opfylde dens bindingskrav og opnå stabilitet.
Sidste artikelHvilke bindinger har calcium og klor til fælles med brintnitrogen?
Næste artikelHvad er det procentvise natrium i oxid?
 Varme artikler
Varme artikler
-
 Kæmpe ladningsomvendelse observeret for første gangSnapshots til distribution af ioner nær en negativt ladet plan overflade ved forskellige dielektriske kontraster. Kredit:Jianzhong Wu, University of California, Riverside Ladede overflader nedsænk
Kæmpe ladningsomvendelse observeret for første gangSnapshots til distribution af ioner nær en negativt ladet plan overflade ved forskellige dielektriske kontraster. Kredit:Jianzhong Wu, University of California, Riverside Ladede overflader nedsænk -
 Super-adsorberende MOF fanger dobbelt så meget i vandDenne figur viser strukturen Hydrolytisk stabil og meget porøs Cr-soc-MOF-1, som kan fange dobbelt sin vægt i adsorberet vand. Kredit:Prof.Mohamed Eddaoudi (KAUST) Materialekemikere i Kongeriget S
Super-adsorberende MOF fanger dobbelt så meget i vandDenne figur viser strukturen Hydrolytisk stabil og meget porøs Cr-soc-MOF-1, som kan fange dobbelt sin vægt i adsorberet vand. Kredit:Prof.Mohamed Eddaoudi (KAUST) Materialekemikere i Kongeriget S -
 Registrering af flere sepsis -biomarkører fra fuldblod - hurtigt, nøjagtig, og billigeWyss Institute forskere har udviklet eRapid-teknologi som en affinitetsbaseret, lavpris elektrokemisk diagnostisk sensorplatform til multiplex påvisning af klinisk relevante sepsis biomarkører i fuldb
Registrering af flere sepsis -biomarkører fra fuldblod - hurtigt, nøjagtig, og billigeWyss Institute forskere har udviklet eRapid-teknologi som en affinitetsbaseret, lavpris elektrokemisk diagnostisk sensorplatform til multiplex påvisning af klinisk relevante sepsis biomarkører i fuldb -
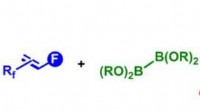 Kemikere frigør potentialet for fluoralkenerSyntesevej til forskellige fluoralkener via defluorborylering af polyfluoralkener. Kredit:© 2017 Osaka University, RIKEN, og Tokyo Medical and Dental University En af de stærkeste kemiske bindinge
Kemikere frigør potentialet for fluoralkenerSyntesevej til forskellige fluoralkener via defluorborylering af polyfluoralkener. Kredit:© 2017 Osaka University, RIKEN, og Tokyo Medical and Dental University En af de stærkeste kemiske bindinge
- Hvad er indium lavet af?
- Hvordan udvikler stjerner sig langs hovedsekvensen?
- Hvordan oprettes elektricitet, og hvorfor?
- Hvad kan meningsmålinger fortælle os om rigsretssagen? En identitetspolitisk ekspert har svaret.
- Hvor er uran placeret i Caribien?
- Hvad er en type stof, som bølger kan bevæge sig igennem?


