Hvor mange gram aluminiumhydroxid opnås fra 17,2 sulfid?
* Kemiske reaktioner er nødvendige: Konvertering af aluminiumssulfid til aluminiumhydroxid kræver en kemisk reaktion. Du skal kende den specifikke reaktion, der vil blive brugt. For eksempel reagerer du muligvis aluminiumssulfid med vand eller en syre.
* støkiometri: Selv ved at kende reaktionen, skal du bruge støkiometri til at beregne massen af produceret aluminiumshydroxid. Støkiometri er studiet af de kvantitative forhold mellem reaktanter og produkter i kemiske reaktioner. Den bruger afbalancerede kemiske ligninger til at bestemme de involverede stoffer.
For at få et svar, har du brug for:
1. den afbalancerede kemiske ligning: Dette vil fortælle dig molforholdet mellem aluminiumsulfid og aluminiums hydroxid.
2. de molære masser: Du har brug for de molære masser af aluminiumssulfid (Al₂s₃) og aluminiums hydroxid (AL (OH) ₃) for at omdanne mellem gram og mol.
Lad os illustrere med en eksempelreaktion:
reaktion:
Al₂s₃ + 6H₂O → 2Al (OH) ₃ + 3H₂S
trin til beregning af massen af aluminiumshydroxid:
1. Balance ligningen: Ligningen ovenfor er allerede afbalanceret.
2. Molmasser:
* Al₂s₃:(2 x 26,98 g/mol Al) + (3 x 32,06 g/mol s) =150,16 g/mol
* Al (OH) ₃:(26,98 g/mol Al) + (3 x 16,00 g/mol O) + (3 x 1,01 g/mol H) =78,00 g/mol
3. Konverter gram af aluminiumssulfid til mol:
* mol Al₂s₃ =(17,2 g Al₂s₃) / (150,16 g / mol al₂s₃) =0,115 mol Al₂s₃
4. Brug molforholdet fra den afbalancerede ligning:
* Den afbalancerede ligning viser, at 1 mol Al₂s₃ producerer 2 mol Al (OH) ₃.
* mol Al (OH) ₃ =(0,115 mol al₂s₃) x (2 mol al (OH) ₃ / 1 mol al₂s₃) =0,230 mol al (OH) ₃
5. Konverter mol af aluminiumshydroxid til gram:
* Gram Al (OH) ₃ =(0,230 mol Al (OH) ₃) X (78,00 g/mol Al (OH) ₃) =17,94 g Al (OH) ₃
Derfor, hvis du reagerer 17,2 g aluminiumssulfid med vand i henhold til den givne reaktion, ville du opnå ca. 17,94 g aluminiums hydroxid.
 Varme artikler
Varme artikler
-
 Imaging den kemiske struktur af individuelle molekyler, atom for atomBrookhaven Lab-fysiker Percy Zahl med det ikke-kontaktede atomkraftmikroskop, han tilpassede og brugte på Center for Functional Nanomaterials (CFN) til at afbilde nitrogen- og svovlholdige molekyler i
Imaging den kemiske struktur af individuelle molekyler, atom for atomBrookhaven Lab-fysiker Percy Zahl med det ikke-kontaktede atomkraftmikroskop, han tilpassede og brugte på Center for Functional Nanomaterials (CFN) til at afbilde nitrogen- og svovlholdige molekyler i -
 Kunstig kemiker kombinerer AI, robotik til at udføre autonom F&UForskere har udviklet en teknologi kaldet Kunstig kemiker, som inkorporerer AI og et automatiseret system til udførelse af kemiske reaktioner for at fremskynde F&U og fremstilling af kommercielt ønske
Kunstig kemiker kombinerer AI, robotik til at udføre autonom F&UForskere har udviklet en teknologi kaldet Kunstig kemiker, som inkorporerer AI og et automatiseret system til udførelse af kemiske reaktioner for at fremskynde F&U og fremstilling af kommercielt ønske -
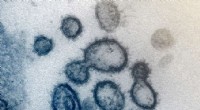 Nyt værktøj trækker undvigende COVID-19-markør fra menneskeblodDette transmissionselektronmikroskopbillede viser SARS-CoV-2 - også kendt som 2019-nCoV, virussen, der forårsager COVID-19 - isoleret fra en patient i USA. Viruspartikler er vist, der dukker op fra ov
Nyt værktøj trækker undvigende COVID-19-markør fra menneskeblodDette transmissionselektronmikroskopbillede viser SARS-CoV-2 - også kendt som 2019-nCoV, virussen, der forårsager COVID-19 - isoleret fra en patient i USA. Viruspartikler er vist, der dukker op fra ov -
 Nanomaterialer - korte polymerer, stor indflydelseForskere brugte computersimuleringer til at producere billeder af polymer nanokompositmaterialer. Nanopartikler er vist i pink og lange polymerkæder i cyan. Kredit:Jan-Michael Y. Carrillo/ORNL, US Dep
Nanomaterialer - korte polymerer, stor indflydelseForskere brugte computersimuleringer til at producere billeder af polymer nanokompositmaterialer. Nanopartikler er vist i pink og lange polymerkæder i cyan. Kredit:Jan-Michael Y. Carrillo/ORNL, US Dep
- Videostjerner:Russiske børnebloggere scorer millioner af likes
- Hvad er en stejl bakke, der dannes omkring vulkansk udluftning og kan rejse sig op til tusind meter?…
- Det mest detaljerede radiokort over Mælkevejen
- Hvordan mikrohabitat påvirker bakteriesamfund i et semi-tørt økosystem
- Hvilken type energi er parafin?
- Hvordan vi matcher – eller overgår naturens evne til at lave stærke, seje letvægtsstrukturmateria…


