Har KCL et højere kogepunkt end CO2?
* ionisk vs. kovalent binding: KCL er en ionisk forbindelse, hvilket betyder, at den dannes af den elektrostatiske tiltrækning mellem positivt ladede kaliumioner (K+) og negativt ladede chloridioner (CL-). Disse ioniske bindinger er meget stærke. CO2 er en kovalent forbindelse med carbon- og iltatomer, der deler elektroner. Kovalente bindinger er generelt svagere end ioniske bindinger.
* Intermolekylære kræfter: De stærke ioniske bindinger i KCL fører til stærke elektrostatiske interaktioner mellem ionerne, hvilket kræver en masse energi til at overvinde og få forbindelsen til at koge. CO2 oplever på den anden side kun svage intermolekylære kræfter (London -spredningskræfter) mellem dens molekyler.
kogepunkter:
* kcl: 1420 ° C (2588 ° F)
* CO2: -78,5 ° C (-109,3 ° F)
Den signifikante forskel i kogepunkter er et direkte resultat af forskellene i binding og intermolekylære kræfter.
 Varme artikler
Varme artikler
-
 Oplader ind i fremtiden – nyt stensalt til brug i genopladelige magnesiumbatterierEn unik metode til at bruge nyt stensalt i genopladelige magnesiumbatterier. Kredit:Tokyo University of Science Livet i dag afhænger i høj grad af elektricitet. Imidlertid, den utrættelige eftersp
Oplader ind i fremtiden – nyt stensalt til brug i genopladelige magnesiumbatterierEn unik metode til at bruge nyt stensalt i genopladelige magnesiumbatterier. Kredit:Tokyo University of Science Livet i dag afhænger i høj grad af elektricitet. Imidlertid, den utrættelige eftersp -
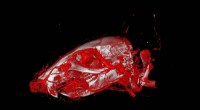 Øget anvendelighed og præcision i vaskulær billeddannelse3-D billeddannelse af blodkarrene i et musehoved ved hjælp af røntgencomputertomografi og det nyudviklede kontrastmiddel XlinCA. Kredit:Willy Kuo, Universitetet i Zürich Forskere ved universitetet
Øget anvendelighed og præcision i vaskulær billeddannelse3-D billeddannelse af blodkarrene i et musehoved ved hjælp af røntgencomputertomografi og det nyudviklede kontrastmiddel XlinCA. Kredit:Willy Kuo, Universitetet i Zürich Forskere ved universitetet -
 Ny biobrændstofteknologi reducerer produktionstiden markantCigdem Eskicioglu er professor i ingeniørvidenskab ved UBCs Okanagan Campus. Kredit:UBC Okanagan Ny forskning fra en professor i teknik på UBCs Okanagan Campus kan indeholde nøglen til biobrændsto
Ny biobrændstofteknologi reducerer produktionstiden markantCigdem Eskicioglu er professor i ingeniørvidenskab ved UBCs Okanagan Campus. Kredit:UBC Okanagan Ny forskning fra en professor i teknik på UBCs Okanagan Campus kan indeholde nøglen til biobrændsto -
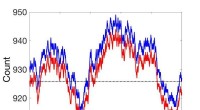 Ikke-steady state massehandlingsdynamik genovervejetSammenligninger mellem ikke-steady state stokastiske kinetiske simuleringer (rød) og simuleringer ved brug af koblet reaktionssætning (blå). Kredit:Pacific Northwest National Laboratory Masseaktio
Ikke-steady state massehandlingsdynamik genovervejetSammenligninger mellem ikke-steady state stokastiske kinetiske simuleringer (rød) og simuleringer ved brug af koblet reaktionssætning (blå). Kredit:Pacific Northwest National Laboratory Masseaktio
- Der er utilstrækkelige beviser for, at din solcreme skader koralrev
- Autoshow ligner mere CES end ikke
- Hvad betyder sublimering i videnskab?
- Hvad er en kemisk formel for magnesiumcarbonat indeholder et atomcarbon og tre iltatomer?
- Hvad fortæller Shadow Zone forskere om jordens interiør?
- Hvad er formlen til at beregne Jorden Bulge?


