Hvorfor mister beryllium elektroner, når man danner ioniske bindinger, mens svovl får elektroner?
beryllium (BE):
* Elektronkonfiguration: 1S² 2S²
* Valenselektroner: 2
* tendens: Beryllium har kun 2 valenselektroner. For at opnå en stabil oktet er det lettere for det at miste Disse 2 elektroner, hvilket efterlader det med en fuld 1S² -skal. Dette resulterer i en +2 ladning, der danner en være²⁺ ion.
svovl (er):
* Elektronkonfiguration: 1S² 2S² 2P⁶ 3S² 3P⁴
* Valenselektroner: 6
* tendens: Svovl har 6 valenselektroner. For at opnå en stabil oktet er det lettere for det at vinde 2 elektroner, der afslutter sin 3p orbital. Dette resulterer i en -2 -ladning, der danner en s²⁻ion.
Kortfattet:
* Beryllium har en lavere elektronegativitet (tendens til at tiltrække elektroner) end svovl.
* Det er energisk gunstigt for beryllium at miste 2 elektroner og svovl for at vinde 2 elektroner, hvilket fører til en stabil ionisk forbindelse (som BES), hvor de modsatte ladede ioner tiltrækkes af hinanden.
 Varme artikler
Varme artikler
-
 Hydrogel kontrollerer cellevækst uden for kroppenKredit:CC0 Public Domain Kemikere ved Radboud Universitet opdagede et unikt materiale i 2013. Fra en syntetisk polymer ved navn polyisocyanopeptid (PIC), de lavede en gel, der opfører sig som den
Hydrogel kontrollerer cellevækst uden for kroppenKredit:CC0 Public Domain Kemikere ved Radboud Universitet opdagede et unikt materiale i 2013. Fra en syntetisk polymer ved navn polyisocyanopeptid (PIC), de lavede en gel, der opfører sig som den -
 Kemikere udvikler en metode til at syntetisere forbindelser til lægemidlerEt team af kemikere fra RUDN University foreslog en universel metode til syntetisering af thienoindolizin -derivater. På grund af deres særlige egenskaber, disse stoffer kan bruges til fremstilling af
Kemikere udvikler en metode til at syntetisere forbindelser til lægemidlerEt team af kemikere fra RUDN University foreslog en universel metode til syntetisering af thienoindolizin -derivater. På grund af deres særlige egenskaber, disse stoffer kan bruges til fremstilling af -
 Nyt materiale opfanger kuldioxidDenne nye porøse koordinationspolymer har propelformede molekylære strukturer, der gør det muligt selektivt at opfange CO2, og effektivt omdanne CO2 til nyttige kulstofmaterialer. Kredit:Mindy Takamiy
Nyt materiale opfanger kuldioxidDenne nye porøse koordinationspolymer har propelformede molekylære strukturer, der gør det muligt selektivt at opfange CO2, og effektivt omdanne CO2 til nyttige kulstofmaterialer. Kredit:Mindy Takamiy -
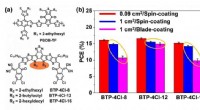 Organisk fotovoltaisk celle med 17% effektivitet og overlegen bearbejdelighed til belægning i stort…(a) Molekylære strukturer af PBDB-TF og BTP-4Cl-X, X repræsenterer 8, 12 eller 16. b) statistik over OPV -celle under forskellige forberedelsesbetingelser. Kredit:Science China Press Organiske fot
Organisk fotovoltaisk celle med 17% effektivitet og overlegen bearbejdelighed til belægning i stort…(a) Molekylære strukturer af PBDB-TF og BTP-4Cl-X, X repræsenterer 8, 12 eller 16. b) statistik over OPV -celle under forskellige forberedelsesbetingelser. Kredit:Science China Press Organiske fot
- Hvor meget varmeenergi skal tilsættes til 1 kg sølvændring af dens temperatur fra -40 grader C -2…
- Hvad er den cellestruktur, der indeholder DNA og kontrollerer funktioner af kaldet?
- Hvordan kan den samme mængde energi overføres, hvis kræfter, der virker på objekt, er forskellig…
- Kunne sydamerikanske vulkaner have udløst hvaludryddelse?
- FADO – et banebrydende værktøj til at rekonstruere galaksernes historie
- Hvad er det løvfældende skovklima?


