Hvilket element reagerer hurtigt med vand for at producere brint?
Her er hvorfor:
* alkalimetaller (Gruppe 1 på den periodiske tabel:Lithium, natrium, kalium, rubidium, cæsium og francium) er meget reaktive.
* De har en enkelt valenselektron, hvilket gør dem ivrige efter at miste det og danne en +1 -kation.
* Denne reaktivitet forstærkes af deres lave ioniseringsenergier, hvilket betyder, at det kræver meget lidt energi at fjerne den enkelte elektron.
Når alkalimetaller reagerer med vand, donerer de deres elektron til et hydrogenatom i vandmolekylet og danner brintgas (H₂) og et metalhydroxid.
Eksempel:
* Natriumreaktion med vand:
2NA (S) + 2H₂O (L) → 2NAOH (AQ) + H₂ (G)
Reaktionen er eksoterm, hvilket betyder, at den frigiver varme, og i tilfælde af natrium kan brintgassen antænde.
Vigtig note: Denne reaktion er meget farlig og bør kun udføres af erfarne fagfolk i en kontrolleret laboratorieindstilling.
Sidste artikelHvad er den kemiske formel af zinkdikromat?
Næste artikelHvordan rengøring af kobber pletter en krone vedrører kemi?
 Varme artikler
Varme artikler
-
 Ny metode til hurtigere og enklere produktion af lipiderede proteinerI Journal of the American Chemical Society, forskere fra Graz University of Technology og University of Wien præsenterer en ny metode til produktion af lipidproteiner. Sammenlignet med etablerede meto
Ny metode til hurtigere og enklere produktion af lipiderede proteinerI Journal of the American Chemical Society, forskere fra Graz University of Technology og University of Wien præsenterer en ny metode til produktion af lipidproteiner. Sammenlignet med etablerede meto -
 Svinekød stort set fri for rester af veterinærlægemidlerSort peber svinekoteletter med melasse smør. Kredit:National Pork Board I en grundlæggende undersøgelse af mere end tusind svinenyreprøver, Der blev næsten ikke fundet rester af veterinærlægemidle
Svinekød stort set fri for rester af veterinærlægemidlerSort peber svinekoteletter med melasse smør. Kredit:National Pork Board I en grundlæggende undersøgelse af mere end tusind svinenyreprøver, Der blev næsten ikke fundet rester af veterinærlægemidle -
 Øjne blinker på en chipDen nye hornhinde-på-en-chip-enhed kan gengive trykket fra bevægelige tårer inde i et blinkende øjenlåg, og kan mere præcist teste virkningerne af lægemidler på det menneskelige øje. Kredit:Mindy Taka
Øjne blinker på en chipDen nye hornhinde-på-en-chip-enhed kan gengive trykket fra bevægelige tårer inde i et blinkende øjenlåg, og kan mere præcist teste virkningerne af lægemidler på det menneskelige øje. Kredit:Mindy Taka -
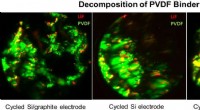 Mod omkostningseffektive løsninger til næste generations forbrugerelektronik, elbiler og elnetNedbrydningen af et polyvinylidenfluorid (PVDF) bindemiddel i et højenergibatteri. Kredit:Jigang Zhou Jagten på et bedre lithium-ion-batteri - et, der kunne holde en mobiltelefon i gang i dagevi
Mod omkostningseffektive løsninger til næste generations forbrugerelektronik, elbiler og elnetNedbrydningen af et polyvinylidenfluorid (PVDF) bindemiddel i et højenergibatteri. Kredit:Jigang Zhou Jagten på et bedre lithium-ion-batteri - et, der kunne holde en mobiltelefon i gang i dagevi


