Hvor mange nitrogenmolekyler er indeholdt i 1,00 L GAS ved ATM og 298 K Hvordan atomer?
1. Brug den ideelle gaslov:
Den ideelle gaslov siger:PV =NRT
Hvor:
* P =pres (ATM)
* V =volumen (l)
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (k)
2. Løs for antallet af mol (n):
* N =PV / RT
* n =(1 atm * 1,00 L) / (0,0821 L · ATM / Mol · K * 298 K)
* n ≈ 0,0409 mol
3. Konverter mol til molekyler:
* Avogadros nummer fortæller os, at 1 mol indeholder 6,022 x 10²³ molekyler.
* Antal molekyler =n * Avogadro's nummer
* Antal molekyler ≈ 0,0409 mol * 6,022 x 10²³ molekyler/mol
* Antal molekyler ≈ 2,46 x 10²² molekyler
Derfor er der ca. 2,46 x 10²² nitrogenmolekyler i 1,00 L GAS ved 1 atm og 298 K.
 Varme artikler
Varme artikler
-
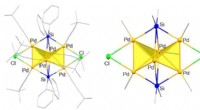 Sommerfugleformet palladium subnano-klynge bygget i 3-DHele (venstre) og kernestrukturen (højre) af 3-D klyngemolekyle baseret på palladium. Kredit:2019 Yusuke Sunada, Institut for Industrividenskab, Universitetet i Tokyo Miniaturisering er fremskridt
Sommerfugleformet palladium subnano-klynge bygget i 3-DHele (venstre) og kernestrukturen (højre) af 3-D klyngemolekyle baseret på palladium. Kredit:2019 Yusuke Sunada, Institut for Industrividenskab, Universitetet i Tokyo Miniaturisering er fremskridt -
 Indstilling af en TRAP for pandemi-fremkaldende viraTRAP-visningsmetoden fisker efter syntetiske proteiner fra et bibliotek af billioner efter dem, der kan målrette mod SARS-CoV-2. Tilgangen var i stand til at identificere proteiner, der kan bruges til
Indstilling af en TRAP for pandemi-fremkaldende viraTRAP-visningsmetoden fisker efter syntetiske proteiner fra et bibliotek af billioner efter dem, der kan målrette mod SARS-CoV-2. Tilgangen var i stand til at identificere proteiner, der kan bruges til -
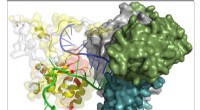 Forskere undersøger strukturen i en nøgleregion af langtidsprotein -telomeraseModel af telomerase katalytisk underenhed af H. polymorpha med fragmenter af telomerase RNA og telomert DNA. Rester, der deltager i bindingen af oligonukleotider, er markeret med rødt i TED-domæne
Forskere undersøger strukturen i en nøgleregion af langtidsprotein -telomeraseModel af telomerase katalytisk underenhed af H. polymorpha med fragmenter af telomerase RNA og telomert DNA. Rester, der deltager i bindingen af oligonukleotider, er markeret med rødt i TED-domæne -
 Interaktion med nukleart affald i miljøet kan være mere kompliceret, end man engang troedeDen glødende/lyserøde prøve på højre side er en egentlig prøve, der indeholder radioaktivt curium og proteinet lanmodulin, under et fluorescensspektroskopiforsøg ved LLNL. Proteinet får curium til at
Interaktion med nukleart affald i miljøet kan være mere kompliceret, end man engang troedeDen glødende/lyserøde prøve på højre side er en egentlig prøve, der indeholder radioaktivt curium og proteinet lanmodulin, under et fluorescensspektroskopiforsøg ved LLNL. Proteinet får curium til at
- Hvordan påvirker klimaændringer biodiversitet?
- Bæredygtig byudvikling:Hvordan sammenligner finske byer sig?
- Hvad gør lyd, når den bevæger sig væk fra objektet, der laver lyd?
- Effektiv regering redder liv i cykloner, andre katastrofer
- Hvilken type stof er korn?
- Hvordan bæres energi fra solen til Jorden?


