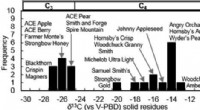
Hvorfor er der to kloratomer for hvert enkelt atom af magnesium?
Her er en sammenbrud:
* magnesium (mg) er i gruppe 2 i den periodiske tabel, hvilket betyder, at den har 2 valenselektroner (elektroner i dets yderste skal). Det mister let disse to elektroner for at opnå en stabil, fuld ydre skal og bliver en magnesiumion (mg²⁺) med en +2 opladning.
* klor (Cl) er i gruppe 17 i den periodiske tabel, hvilket betyder, at den har 7 valenselektroner. Det har brug for endnu en elektron for at opnå en stabil, fuld ydre skal. Det får et elektron til at blive en chloridion (cl⁻) med en -1 -afgift.
For at opnå elektrisk neutralitet (hvor de positive og negative afgifter balancerer), to chloridioner (2 x -1 =-2) kræves for at afbalancere +2 ladning af magnesiumionen.
Dette danner ionisk sammensat mgcl₂ , hvor den stærke elektrostatiske tiltrækning mellem de modsatte ladede ioner holder forbindelsen sammen.
 Varme artikler
Varme artikler
-
 Hård cider, med en sjat sukkerKredit:American Chemical Society Efteråret er sæsonen for faldende blade, græskar-krydderi-smag alt og æblecider. Alligevel peger ny forskning på, at ud over alkohol, nogle hårde cider kan indehol
Hård cider, med en sjat sukkerKredit:American Chemical Society Efteråret er sæsonen for faldende blade, græskar-krydderi-smag alt og æblecider. Alligevel peger ny forskning på, at ud over alkohol, nogle hårde cider kan indehol -
 Ny separationsproces for nøgleradiodiagnostisk middel reducerer radioaktivt affaldDr. Tobias Chemnitz på testfaciliteten for Mo-99 produktion på FRM II på Garching forskningscampus. Kredit:Reiner Müller, FRM II / TUM Nuklearmedicin bruger blandt andet technetium-99m til tumordia
Ny separationsproces for nøgleradiodiagnostisk middel reducerer radioaktivt affaldDr. Tobias Chemnitz på testfaciliteten for Mo-99 produktion på FRM II på Garching forskningscampus. Kredit:Reiner Müller, FRM II / TUM Nuklearmedicin bruger blandt andet technetium-99m til tumordia -
 Computerprogram kan oversætte en 2-D-tegning i fri form til en DNA-strukturForskere fra MIT og Arizona State University har skabt et computerprogram, der kan oversætte tegninger af vilkårlige former til todimensionelle strukturer lavet af DNA. Kredit:Hyungmin Jun Forsker
Computerprogram kan oversætte en 2-D-tegning i fri form til en DNA-strukturForskere fra MIT og Arizona State University har skabt et computerprogram, der kan oversætte tegninger af vilkårlige former til todimensionelle strukturer lavet af DNA. Kredit:Hyungmin Jun Forsker -
 Reducerer kraftværkernes ferskvandsforbrug med nyt silicafilterSandia National Laboratories forskere, venstre til højre, Tina Nenoff og Pat Brady og tidligere postdoktorudnævnte Koroush Sasan undersøgte, hvordan hydrotalcit kan filtrere silica ud af køletårnets v
Reducerer kraftværkernes ferskvandsforbrug med nyt silicafilterSandia National Laboratories forskere, venstre til højre, Tina Nenoff og Pat Brady og tidligere postdoktorudnævnte Koroush Sasan undersøgte, hvordan hydrotalcit kan filtrere silica ud af køletårnets v
- Hvornår gik Gemini 4 i rummet?
- Hvad er bølgelængden af en lysfrekvens (4,47) (10 eksponent 14) Hz?
- Tidskrystaller og topologiske superledere smelter sammen
- Nyligt opdagede magnetiske interaktioner kan føre til nye måder at manipulere elektronstrømmen på
- Den føderale jury anklager kvinden i Capital One-sagen
- Et multi-skala kropsdel maske styret opmærksomhedsnetværk til person re-identifikation


