Hvorfor udvikler en dipol sig i molekyle?
1. Polære kovalente bindinger:
* Elektronegativitet: Når to atomer med forskellige elektronegativitetsværdier danner en binding, tiltrækker det mere elektronegative atom de delte elektroner stærkere. Dette skaber en delvis negativ ladning (Δ-) på det mere elektronegative atom og en delvis positiv ladning (Δ+) på det mindre elektronegative atom.
* Eksempel: I et vandmolekyle (H₂O) er ilt mere elektronegativt end brint. Dette betyder, at iltatomet trækker de delte elektroner tættere på sig selv, hvilket gør iltens ende af molekylet lidt negativt, og brint ender lidt positiv.
2. Molekylær geometri:
* asymmetrisk form: Selv hvis de individuelle bindinger inden for et molekyle er ikke -polære (lige deling af elektroner), kan molekylet stadig have et dipolmoment, hvis molekylet har en asymmetrisk form. Dette skyldes, at de delvise afgifter fra de enkelte obligationer ikke annullerer hinanden.
* Eksempel: Kuldioxid (CO₂) har to polære bindinger (C =O), men molekylet er lineært. Dipolmomenterne i de to bindinger annullerer hinanden, hvilket gør molekylet ikke -polært. Vand har imidlertid en bøjet form. De to polære bindinger annullerer ikke hinanden, hvilket resulterer i et netto dipolmoment for hele vandmolekylet.
Kortfattet:
* polære kovalente obligationer: Forskel i elektronegativitet mellem atomer skaber delvise ladninger.
* asymmetrisk form: Ikke-afgifter af individuelle bindingsdipoler på grund af ujævn fordeling af elektrondensitet.
Begge disse faktorer bidrager til udviklingen af et dipolmoment inden for et molekyle. Dette dipolmoment kan have betydelige påvirkninger på molekylets egenskaber, herunder dets opløselighed, kogepunkt og interaktion med andre molekyler.
 Varme artikler
Varme artikler
-
 Hvordan mikrober i starterkulturer gør fermenteret pølse velsmagendeKredit:Pixabay/CC0 Public Domain Mikrober i starterkulturer giver mad som surdejsbrød en markant pift og længere holdbarhed. yoghurt og kimchi gennem gæringsprocessen. For at få en bedre forståels
Hvordan mikrober i starterkulturer gør fermenteret pølse velsmagendeKredit:Pixabay/CC0 Public Domain Mikrober i starterkulturer giver mad som surdejsbrød en markant pift og længere holdbarhed. yoghurt og kimchi gennem gæringsprocessen. For at få en bedre forståels -
 Forvandling af stamceller til knogler med nanolerforstærket hydrogelKredit:CC0 Public Domain Adjunkt Alireza Dolatshahi-Pirouz og kolleger har udviklet en hydrogel, der kombinerer syntetiske materialer med levende celler, og kan omdanne stamceller til knogler uden
Forvandling af stamceller til knogler med nanolerforstærket hydrogelKredit:CC0 Public Domain Adjunkt Alireza Dolatshahi-Pirouz og kolleger har udviklet en hydrogel, der kombinerer syntetiske materialer med levende celler, og kan omdanne stamceller til knogler uden -
 Diamanter i dine enheder:Giver kraft til næste generation af energilagringI en banebrydende undersøgelse, videnskabsmænd fra Japan bruger nanodiamanter til at konstruere superkondensatorer, der i vid udstrækning kan bruges som et mere effektivt alternativ til konventionelle
Diamanter i dine enheder:Giver kraft til næste generation af energilagringI en banebrydende undersøgelse, videnskabsmænd fra Japan bruger nanodiamanter til at konstruere superkondensatorer, der i vid udstrækning kan bruges som et mere effektivt alternativ til konventionelle -
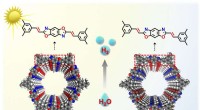 Nye isomere vinylen-bundne kovalente organiske rammer udviklet med distinkte fotokatalytiske egenska…De isomere vinylen-bundne kovalente organiske rammer. Kredit:NIMTE Forskere ledet af prof. Zahng Tao ved Ningbo Institute of Materials Technology and Engineering (NIMTE) fra det kinesiske videnskab
Nye isomere vinylen-bundne kovalente organiske rammer udviklet med distinkte fotokatalytiske egenska…De isomere vinylen-bundne kovalente organiske rammer. Kredit:NIMTE Forskere ledet af prof. Zahng Tao ved Ningbo Institute of Materials Technology and Engineering (NIMTE) fra det kinesiske videnskab


