Hvilke elementer, når de kombineres med fluor, ville danne en ionisk forbindelse?
Forståelse af ioniske bindinger
Ioniske bindinger dannes mellem metaller og ikke -metaller. Metaller har en tendens til at miste elektroner til dannelse af positive ioner (kationer), mens ikke -metaller har en tendens til at få elektroner til at danne negative ioner (anioner).
fluorens rolle
Fluor er en meget elektronegativ ikke -metal. Dette betyder, at det har en stærk tendens til at få en elektron og danne en negativ ion (F⁻).
elementer, der danner ioniske forbindelser med fluor
For at danne en ionisk forbindelse med fluor skal et element være et metal, der let kan miste elektroner for at danne en positiv ion. Her er nogle eksempler:
* gruppe 1 (alkalimetaller): Li, NA, K, RB, CS
* gruppe 2 (alkaliske jordmetaller): Be, Mg, CA, SR, BA
* Overgangsmetaller: Mange overgangsmetaller kan danne ioniske forbindelser med fluor, herunder Fe, Cu, Zn osv.
* Nogle metalloider: Elementer som aluminium (AL) og TIN (SN) kan undertiden danne ioniske forbindelser med fluor.
Eksempler på ioniske forbindelser med fluor
* lithiumfluorid (LIF)
* natriumfluorid (NAF)
* calciumfluorid (caf₂)
* jern (III) fluorid (FEF₃)
Vigtig note: Mens mange metaller danner ioniske forbindelser med fluor, er der undtagelser. For eksempel er guld (AU) og platin (PT) mindre tilbøjelige til at danne ioniske forbindelser på grund af deres høje ioniseringsenergier.
Sidste artikelHvorfor udvikler en dipol sig i molekyle?
Næste artikelHvorfor natriumekstrakt normalt er alkalisk i naturen?
 Varme artikler
Varme artikler
-
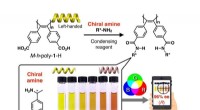 Farvekodning af molekylære spejlbillederOrganiske farveindikator-forbindelser bestående af enhånds spiralformede poly(diphenylacetylen)er med carboxygrupper i sidekæderne (M–h-poly-1-H) til at skelne mellem enantiomerer af chirale aminer og
Farvekodning af molekylære spejlbillederOrganiske farveindikator-forbindelser bestående af enhånds spiralformede poly(diphenylacetylen)er med carboxygrupper i sidekæderne (M–h-poly-1-H) til at skelne mellem enantiomerer af chirale aminer og -
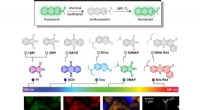 Et-atoms switch overlader fluorescerende farvestofferØverst, en sekvens viser designet af thio-caged farvestoffer designet på Rice University til at blive udløst af synligt lys. I bunden, konfokal og superopløsningsbilleddannelse af en lipiddråbe i leve
Et-atoms switch overlader fluorescerende farvestofferØverst, en sekvens viser designet af thio-caged farvestoffer designet på Rice University til at blive udløst af synligt lys. I bunden, konfokal og superopløsningsbilleddannelse af en lipiddråbe i leve -
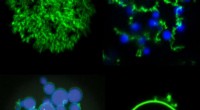 Varme og lys skaber nye biokompatible mikropartiklerBlandinger af POPer (grøn) og ELPer (blå) kan bruges til at skabe en række nye mikropartikelarkitekturer, herunder (med uret fra øverst til venstre) porøse partikler, frugt-på-vin-netværk, enkelte hul
Varme og lys skaber nye biokompatible mikropartiklerBlandinger af POPer (grøn) og ELPer (blå) kan bruges til at skabe en række nye mikropartikelarkitekturer, herunder (med uret fra øverst til venstre) porøse partikler, frugt-på-vin-netværk, enkelte hul -
 Kondensforbedring:Mod praktiske energi- og vandanvendelser(A) dråbevis kondens på en hydrofob almindelig overflade. (B) filmisk kondens på en hydrofil slet overflade. (C) Suge flow kondens på en hi-mesh overflade bestående af dråbe-til-film koalescens og fil
Kondensforbedring:Mod praktiske energi- og vandanvendelser(A) dråbevis kondens på en hydrofob almindelig overflade. (B) filmisk kondens på en hydrofil slet overflade. (C) Suge flow kondens på en hi-mesh overflade bestående af dråbe-til-film koalescens og fil
- Når vandet selv kombineres kemisk med et eller andet element eller mineral kaldes det?
- Fysikere udvikler nyt materiale til vandafsaltning
- Hvordan vision fungerer
- Dommer godkender 100 millioner $ Googles privatlivsaftale. Her er, hvor meget indbyggere i Illinois …
- Hvorfor opbevares alkalimetaller i parafin?
- Sådan beregnes modstand i en parallel kredsløb


