Hvordan adskiller massetalet sig fra atom af et atom?
atomnummer
* Definition: Antallet af protoner i kernen i et atom.
* Betydning:
* Unik identifikator: Definerer elementet. Alle atomer i et givet element har det samme atomnummer. For eksempel har alle carbonatomer et atomnummer på 6.
* bestemmer kemisk adfærd: Antallet af protoner dikterer antallet af elektroner i et neutralt atom, som igen styrer atomets kemiske egenskaber.
massenummer
* Definition: Det samlede antal protoner og neutroner i kernen i et atom.
* Betydning:
* omtrentlig atommasse: Massenummeret er meget tæt på atomets atommasse (målt i atommasseenheder eller AMU). Imidlertid kan den faktiske atommasse variere lidt på grund af tilstedeværelsen af isotoper.
* Identificerer isotoper: Atomer af det samme element kan have forskellige antal neutroner, hvilket fører til isotoper. Isotoper har det samme atomnummer, men forskellige massetal.
Nøgleforskelle
* sammensætning: Atomnummer tæller kun protoner, mens massetal inkluderer både protoner og neutroner.
* Identitet: Atomnummer definerer elementet, mens massetal differentierer isotoper af det samme element.
* Betydning: Atomnummer bestemmer kemisk opførsel, mens massetal giver et mål for atomets masse.
eksempel
Overvej carbon-12:
* atomnummer: 6 (hvilket betyder, at det har 6 protoner)
* Massenummer: 12 (hvilket betyder, at det har 6 protoner + 6 neutroner)
Kortfattet
Atomnummeret definerer elementet og dets kemiske opførsel, mens massetalet afspejler atomets samlede masse under hensyntagen til både protoner og neutroner.
Sidste artikelHvad er bromoxid?
Næste artikelForklar hvorfor brint er unikt?
 Varme artikler
Varme artikler
-
 Forskere finder en ny anvendelse af affaldUBCO Postdoc-stipendiat Dr. Chinchu Cherian, sammen med lektor Dr. Sumi Siddiqua, undersøger et vejbygningsmateriale lavet delvist med genanvendt træaske. Kredit:UBCO Affaldsmaterialer fra papirma
Forskere finder en ny anvendelse af affaldUBCO Postdoc-stipendiat Dr. Chinchu Cherian, sammen med lektor Dr. Sumi Siddiqua, undersøger et vejbygningsmateriale lavet delvist med genanvendt træaske. Kredit:UBCO Affaldsmaterialer fra papirma -
 Nye biomaterialer kan finjusteres til medicinske anvendelserKredit:Unsplash/CC0 Public Domain Det er lykkedes forskere i Storbritannien og USA at finjustere et nyt termoplastisk biomateriale, så både den hastighed, hvormed det nedbrydes i kroppen, og dets
Nye biomaterialer kan finjusteres til medicinske anvendelserKredit:Unsplash/CC0 Public Domain Det er lykkedes forskere i Storbritannien og USA at finjustere et nyt termoplastisk biomateriale, så både den hastighed, hvormed det nedbrydes i kroppen, og dets -
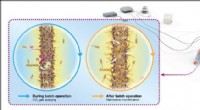 Multifunktionelle porøse ledende membraner hjælper mikrober med at spise sig frem til en hurtigere…Illustration af den mikrobielle elektrosynteseproces, hvorved levende mikrober omdanner kuldioxid til nyttige kemikalier i en elektrokemisk celle via en reduktionsreaktion under påført spænding. Kredi
Multifunktionelle porøse ledende membraner hjælper mikrober med at spise sig frem til en hurtigere…Illustration af den mikrobielle elektrosynteseproces, hvorved levende mikrober omdanner kuldioxid til nyttige kemikalier i en elektrokemisk celle via en reduktionsreaktion under påført spænding. Kredi -
 Flydende støddæmpereKredit:Swiss National Science Foundation Bemærkelsesværdige flydende materialer kaldet kolloider stivner under stød. Forskere finansieret af Swiss National Science Foundation har undersøgt virknin
Flydende støddæmpereKredit:Swiss National Science Foundation Bemærkelsesværdige flydende materialer kaldet kolloider stivner under stød. Forskere finansieret af Swiss National Science Foundation har undersøgt virknin


