Hvor meget ville kogepunktet for vand steg, hvis 4 mol NaCl blev tilsat til 1 kg vand?
1. Forståelse af kogepunkthøjde
Kogepunkthøjde er en kolligativ egenskab, hvilket betyder, at det afhænger af antallet af opløste partikler i en opløsning, ikke deres identitet. Jo flere opløste partikler du tilføjer, jo højere vil kogepunktet være.
2. Brug af formlen
Formlen for kogepunkthøjde er:
ΔT b =i * k b * m
Hvor:
* ΔT b Er kogepunkthøjden (i ° C)
* Jeg er Van't Hoff -faktoren (antal producerede ioner pr. Formelenhed for opløst stof)
* K b er molal kogepunkthøjde konstant for opløsningsmidlet (for vand, k b =0,512 ° C/m)
* m er molaliteten af opløsningen (mol opløst stof pr. Kg opløsningsmiddel)
3. Beregning af van't hoff -faktoren (i)
NaCl dissocieres i to ioner i vand:NA + og cl - . Derfor i =2.
4. Beregning af molalitet (m)
* Du har 4 mol NaCl.
* Du har 1 kg vand.
* Molalitet (m) =4 mol / 1 kg =4 mol / kg
5. Beregning af kogepunkthøjde (ΔT B )
* ΔT b =2 * 0,512 ° C/m * 4 mol/kg =4,096 ° C
6. At finde det nye kogepunkt
* Det normale kogepunkt af vand er 100 ° C.
* Det nye kogepunkt er 100 ° C + 4,096 ° C =104,096 ° C
Derfor ville kogepunktet for vand stige med ca. 4,1 ° C, hvis 4 mol NaCI blev tilsat til 1 kg vand.
 Varme artikler
Varme artikler
-
 Forskning går til nye dybder i hudpeptidundersøgelserDavid Scurr, Seniorforsker, Farmaceutisk Skole. Kredit:University of Nottingham Forskere har for første gang afsløret, at et peptid i et førende skønhedsprodukt kan trænge ind i hudens hårde strat
Forskning går til nye dybder i hudpeptidundersøgelserDavid Scurr, Seniorforsker, Farmaceutisk Skole. Kredit:University of Nottingham Forskere har for første gang afsløret, at et peptid i et førende skønhedsprodukt kan trænge ind i hudens hårde strat -
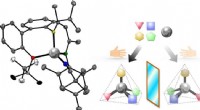 Forskere udvikler katalysator med chiralitet i zinkcentretKonstruktion af chiral zink med høj konfigurationsstabilitet. Til venstre:Molekylær struktur af tetraedrisk chiral zink-kompleks. Den chirale tetraedriske forbindelse har en zinkion i midten (grå kugl
Forskere udvikler katalysator med chiralitet i zinkcentretKonstruktion af chiral zink med høj konfigurationsstabilitet. Til venstre:Molekylær struktur af tetraedrisk chiral zink-kompleks. Den chirale tetraedriske forbindelse har en zinkion i midten (grå kugl -
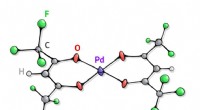 Kemikere accelererede vinylsulfider-reaktionen 10 gangeKatalysatorens opbygning. Kredit:RUDN Universitet Et team af forskere skabte og testede en mere effektiv katalysator til at opnå vinylsulfider. Disse forbindelser kan bruges til udvikling af nye m
Kemikere accelererede vinylsulfider-reaktionen 10 gangeKatalysatorens opbygning. Kredit:RUDN Universitet Et team af forskere skabte og testede en mere effektiv katalysator til at opnå vinylsulfider. Disse forbindelser kan bruges til udvikling af nye m -
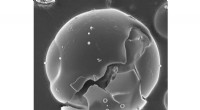 Spraytørring – perfekt dosering takket være lægemiddelkapslerKerne-skal partikel. Kredit:Fraunhofer IGB Instant kaffe og mælkepulver fremstilles ved spraytørring. Fraunhofer-forskere har tilpasset denne teknik til det vanskelige spørgsmål om at inkorporere
Spraytørring – perfekt dosering takket være lægemiddelkapslerKerne-skal partikel. Kredit:Fraunhofer IGB Instant kaffe og mælkepulver fremstilles ved spraytørring. Fraunhofer-forskere har tilpasset denne teknik til det vanskelige spørgsmål om at inkorporere


