Hvorfor hydrazin mere grundlæggende end ammoniak?
* Elektrondensitet: Nitrogenatomerne i både hydrazin og ammoniak har et ensomt par elektroner, som er ansvarlig for deres grundlæggende. I hydrazin er elektrondensiteten på nitrogenatomet imidlertid lidt lavere På grund af tilstedeværelsen af det andet nitrogenatom, der kan trække en vis elektrondensitet tilbage gennem N-N-bindingen.
* induktiv effekt: Den elektronoptagende virkning af det andet nitrogen i hydrazin, kendt som den induktive virkning, svækker elektrondensiteten på nitrogenatomet, hvilket gør det mindre sandsynligt, at det donerer sit ensomme par elektroner og fungerer som en base.
* PKA -værdier: PKA -værdierne for konjugatsyrerne af disse forbindelser understøtter denne observation yderligere. Ammoniumionens PKA (NH₄⁺) er 9,25, mens PKA for hydraziniumionen (N₂H₅⁺) er 8,1. En højere PKA indikerer en svagere syre, hvilket betyder, at den tilsvarende base (ammoniak i dette tilfælde) er stærkere.
Derfor er ammoniak mere grundlæggende end hydrazin.
Det er vigtigt at huske, at styrken af en base afhænger af dens evne til at donere elektroner og danne et binding med en proton (H⁺). Mens både ammoniak og hydrazin har et ensomt par elektroner, gør elektrondensiteten og den induktive virkning i hydrazin det mindre effektivt til at donere disse elektroner og fungere som base.
Sidste artikelNår acetone reagerer med hydrazin i ethanol, hvad dannes der?
Næste artikelEr ammoniumacetat en stærk eller svag elektrolyt?
 Varme artikler
Varme artikler
-
 Opsnuse forfalskede spiritusEn bærbar enhed med en avanceret sensor kan opsnuse forfalskede spiritus. Kredit:Kenneth S. Suslick, Ph.D. Udvandet eller falsk spiritus kan høste økonomiske belønninger for ondsindede personer, m
Opsnuse forfalskede spiritusEn bærbar enhed med en avanceret sensor kan opsnuse forfalskede spiritus. Kredit:Kenneth S. Suslick, Ph.D. Udvandet eller falsk spiritus kan høste økonomiske belønninger for ondsindede personer, m -
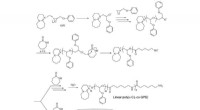 Nye klæbende og termisk stabile epoxyharpikserKredit:Kansai University Epoxyharpikser eller epoxyer er organiske forbindelser, der kan hærdes til klæbende materialer med fremragende termisk stabilitet, mekanisk styrke, og kemisk resistens. Hæ
Nye klæbende og termisk stabile epoxyharpikserKredit:Kansai University Epoxyharpikser eller epoxyer er organiske forbindelser, der kan hærdes til klæbende materialer med fremragende termisk stabilitet, mekanisk styrke, og kemisk resistens. Hæ -
 Nøjagtige lægemiddeldoseringer med protonfælderDaniel Simon, lektor i Laboratoriet for Økologisk Elektronik, Institut for Videnskab og Teknologi ved Linköpings Universitet. Kredit:Thor Balkhed Forskere ved Linköpings Universitet, Sverige, har
Nøjagtige lægemiddeldoseringer med protonfælderDaniel Simon, lektor i Laboratoriet for Økologisk Elektronik, Institut for Videnskab og Teknologi ved Linköpings Universitet. Kredit:Thor Balkhed Forskere ved Linköpings Universitet, Sverige, har -
 NREL undersøger belægninger, der er nødvendige for at koncentrere solenergiForsker Judith Gomez-Vidal fastslog de belægninger, der er nødvendige for at tillade koncentrerende solenergianlæg at opbevare og bruge smeltede salte. Kredit:Dennis Schroeder, NREL 45088 Næste ge
NREL undersøger belægninger, der er nødvendige for at koncentrere solenergiForsker Judith Gomez-Vidal fastslog de belægninger, der er nødvendige for at tillade koncentrerende solenergianlæg at opbevare og bruge smeltede salte. Kredit:Dennis Schroeder, NREL 45088 Næste ge


