Hvilke dele af calciumchloridet tiltrækkes af hvilket vandmolekyle?
calciumioner (Ca²⁺):
* tiltrækning til ilt: De positivt ladede calciumioner (Ca²⁺) tiltrækkes stærkt af de negativt ladede iltatomer i vandmolekyler (H₂O). Dette er på grund af elektrostatisk tiltrækning, hvor modsatte afgifter tiltrækker.
chloridioner (Cl⁻):
* tiltrækning til brint: De negativt ladede chloridioner (CL⁻) tiltrækkes af de positivt ladede hydrogenatomer i vandmolekyler (H₂O). Igen skyldes dette elektrostatisk tiltrækning.
generelt:
* Calciumchloridet opløses i vand, fordi de stærke elektrostatiske attraktioner mellem ionerne og vandmolekylerne overvinder de ioniske bindinger, der holder CaCl₂ -forbindelsen sammen.
* Denne opløsningsproces kaldes hydrering og vandmolekylerne omgiver ionerne og danner en hydratiseringsskal.
Visualisering af interaktionen:
Forestil dig vandmolekylerne som små magneter. Oxygenenden af hvert vandmolekyle har en lidt negativ ladning, mens brintenden har en lidt positiv ladning.
* Calciumionerne (positive) tiltrækkes af iltenderne (negative) af vandmolekylerne.
* Chloridionerne (negative) tiltrækkes af brintenderne (positive) af vandmolekylerne.
Denne stærke interaktion får calciumchloridet til at gå i stykker og opløses i vandet.
Sidste artikelKemisk sammensætning af natriumsulfat?
Næste artikelHvordan kunne du adskille svovl fra sukker?
 Varme artikler
Varme artikler
-
 Kemikere foreslår ny tilgang til syntesen af ABCD-ringsystemet af alpkinidinKredit:RUDN Universitet RUDN University kemikere, sammen med indiske kolleger fra Goa University, har syntetiseret en analog af alkaloid af alpkinidin, et stof med en signifikant cytotoksisk effek
Kemikere foreslår ny tilgang til syntesen af ABCD-ringsystemet af alpkinidinKredit:RUDN Universitet RUDN University kemikere, sammen med indiske kolleger fra Goa University, har syntetiseret en analog af alkaloid af alpkinidin, et stof med en signifikant cytotoksisk effek -
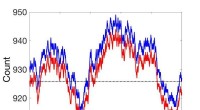 Ikke-steady state massehandlingsdynamik genovervejetSammenligninger mellem ikke-steady state stokastiske kinetiske simuleringer (rød) og simuleringer ved brug af koblet reaktionssætning (blå). Kredit:Pacific Northwest National Laboratory Masseaktio
Ikke-steady state massehandlingsdynamik genovervejetSammenligninger mellem ikke-steady state stokastiske kinetiske simuleringer (rød) og simuleringer ved brug af koblet reaktionssætning (blå). Kredit:Pacific Northwest National Laboratory Masseaktio -
 Hvordan edderkoppesilke en dag kunne bruges i kræftbehandlingKredit:Vadym Lesyk/Shutterstock Kræft er samtidig en af de mest almindelige og ødelæggende sygdomme i vores samfund. Så at finde nye måder at behandle det på er en vedvarende videnskabelig udford
Hvordan edderkoppesilke en dag kunne bruges i kræftbehandlingKredit:Vadym Lesyk/Shutterstock Kræft er samtidig en af de mest almindelige og ødelæggende sygdomme i vores samfund. Så at finde nye måder at behandle det på er en vedvarende videnskabelig udford -
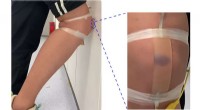 Brudbar kunstig hud kan hjælpe proteser, robotter fornemmer skaderEn kunstig hud, der er fastgjort til en persons knæ, udvikler et lilla blå mærke, når det rammer kraftigt mod et metalkabinet. Kredit:Tilpasset fra ACS Applied Materials &Interfaces Når nogen stød
Brudbar kunstig hud kan hjælpe proteser, robotter fornemmer skaderEn kunstig hud, der er fastgjort til en persons knæ, udvikler et lilla blå mærke, når det rammer kraftigt mod et metalkabinet. Kredit:Tilpasset fra ACS Applied Materials &Interfaces Når nogen stød
- Plastisk nedbrydning i havet bidrager til dets forsuring
- Glas Barometer Fyldningsvejledning
- Parker Solar Probe ser Venus orbital støvring i første fuldstændige visning
- Hvad er det almindelige i fotosynthsis og respiration?
- Hvad er de fire kraftegenskaber?
- Hvad er virkningen af at placere elektroner meget tæt på proton?


