Hvorfor er klor et reaktivt ikke -metal?
1. Høj elektronegativitet: Chlor har en meget høj elektronegativitet (3.16 på Pauling -skalaen), hvilket betyder, at det har en stærk attraktion for elektroner. Dette gør det ivrig efter at få et elektron for at opnå en stabil oktetkonfiguration.
2. Lille atomstørrelse: Klor har en relativt lille atomradius, hvilket betyder, at dens yderste elektron er tættere på kernen og oplever et stærkere træk. Dette øger dens reaktivitet.
3. Syv valenselektroner: Klor har syv elektroner i sin yderste skal. Det har kun brug for endnu en elektron for at afslutte sin oktet og opnå en stabil ædle gaskonfiguration. Dette stærke ønske om at få et elektron gør det meget reaktivt.
4. Stærkt oxidationsmiddel: På grund af sin tendens til at få elektroner fungerer klor som et stærkt oxidationsmiddel. Den oxideres let andre stoffer, accepterer elektroner fra dem og gennemgår reduktion i sig selv.
5. Svag metallisk binding: Klor er et ikke -metal, og ikke -metaller mangler den stærke metalliske binding, der findes i metaller. Dette svækker tiltrækningen mellem kloratomer, hvilket gør dem mere modtagelige for at reagere med andre elementer.
Konsekvenser af reaktivitet:
Chlorens høje reaktivitet gør det til et værdifuldt element i forskellige applikationer. Det bruges i:
* Vandbehandling: Klor bruges til at desinficere vand ved at dræbe bakterier og vira.
* Produktion af blegemiddel: Klor er en nøgleingrediens i blegemiddel, der bruges til hvidtnings- og desinfektionsformål.
* Industrielle kemikalier: Klor bruges til produktion af forskellige industrikemikalier, herunder plast, opløsningsmidler og farmaceutiske stoffer.
Imidlertid gør klorens reaktivitet det også potentielt farligt. Det kan forårsage åndedrætsproblemer og hudirritation. Korrekt håndtering og sikkerhedsforholdsregler er vigtige, når man arbejder med klor.
Sidste artikelHvad er årsagen til gasser, der producerer surt regn?
Næste artikelIndeholder forbindelser altid forskellige typer atomer?
 Varme artikler
Varme artikler
-
 Naturen har mere end én måde at fremstille metan på, siger biokemikereUtah State University biokemikere, fra venstre, Zhi-Yong Yang, Derek Harris, Rhesa Ledbetter og professor Lance Seefeldt, sammen med samarbejdspartnere fra University of Washington og Montana State Un
Naturen har mere end én måde at fremstille metan på, siger biokemikereUtah State University biokemikere, fra venstre, Zhi-Yong Yang, Derek Harris, Rhesa Ledbetter og professor Lance Seefeldt, sammen med samarbejdspartnere fra University of Washington og Montana State Un -
 Ensomme vandmolekyler viser sig at være direktører for supramolekylær kemiBert Meijer, professor i organisk kemi, og postdoktorforsker Nathan van Zee. Kredit:Bart van Overbeeke Forskere inden for supramolekylær kemi støder ofte på overraskende resultater. En brudt forse
Ensomme vandmolekyler viser sig at være direktører for supramolekylær kemiBert Meijer, professor i organisk kemi, og postdoktorforsker Nathan van Zee. Kredit:Bart van Overbeeke Forskere inden for supramolekylær kemi støder ofte på overraskende resultater. En brudt forse -
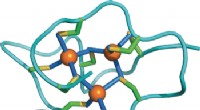 Heavy metal-bindingsdomæne i et cystein-rigt protein kan være havsneglstilpasning til metalspændi…Strukturel tilpasning af et protein til øget metalspænding:NMR -struktur af en marin snegl Metallothionein med et ekstra domæne. Kredit:Wiley En særlig type af små svovlrige proteiner, metallothio
Heavy metal-bindingsdomæne i et cystein-rigt protein kan være havsneglstilpasning til metalspændi…Strukturel tilpasning af et protein til øget metalspænding:NMR -struktur af en marin snegl Metallothionein med et ekstra domæne. Kredit:Wiley En særlig type af små svovlrige proteiner, metallothio -
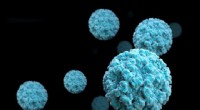 Molekyler fra modermælk og tang foreslår strategier til bekæmpelse af norovirusNorovirus. Kredit:CDC Norovirus er den mest almindelige årsag til gastroenteritis på verdensplan; det forårsager titusindvis af dødsfald hvert år og er særligt risikabelt for børn under 3 år. Hvis
Molekyler fra modermælk og tang foreslår strategier til bekæmpelse af norovirusNorovirus. Kredit:CDC Norovirus er den mest almindelige årsag til gastroenteritis på verdensplan; det forårsager titusindvis af dødsfald hvert år og er særligt risikabelt for børn under 3 år. Hvis
- Hvad vil der højst sandsynligt ske med et anlæg, der ikke modtager nok CO2?
- Nye fund kaster lys over, hvordan bella-møl bruger gift til at tiltrække kammerater
- Hvilke konstellationer er i nærheden af stjernebilledet Tyren?
- Hvorfor er bjerge vigtige for vandforsyning?
- Hvad er den 13. største stat efter område?
- Stjernedannelse brast i Mælkevejen for 2-3 milliarder år siden (Opdatering)


