Heavy metal-bindingsdomæne i et cystein-rigt protein kan være havsneglstilpasning til metalspænding
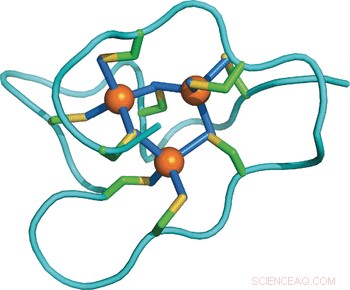
Strukturel tilpasning af et protein til øget metalspænding:NMR -struktur af en marin snegl Metallothionein med et ekstra domæne. Kredit:Wiley
En særlig type af små svovlrige proteiner, metallothionerne, har en ekstraordinær evne til at binde tungmetaller. Et internationalt team af forskere har nu opdaget, at den marine almindelige periwinkle, som i vid udstrækning betragtes som en delikatesse, indeholder den største version af proteinet fundet endnu, med et yderligere cadmium-bindende domæne og en tredjedel højere afgiftningskapacitet. Som de rapporterer i journalen Angewandte Chemie , denne funktion kan hjælpe sneglen med at overleve i tungmetalforurenede miljøer.
Snegle og snegle er kendt for deres spændende evne til at akkumulere og afgifte tungmetaller. De er endda i stand til at skelne mellem cadmium og kobber, da sidstnævnte element er et uundværligt element i deres metabolisme, mens cadmium er giftigt. De afgifter cadmium ved at binde det til metallothionerer, en klasse af små proteiner rige på den svovlholdige cysteinaminosyre. Oliver Zerbe ved universitetet i Zürich, Schweiz, og Reinhard Dallinger ved universitetet i Innsbruck, Østrig, og deres kolleger i Barcelona, Spanien, undersøge udviklingen af disse proteiner som en strategi for at tilpasse gastropoderne til deres nye levesteder - landsnegle har udviklet sig fra marine arter, og måtte finde nye strategier til at klare de højere belastninger af tungmetaller i jorden. Stadig hårdere miljøer findes ved kysterne med deres svingende vandforsyning. Som forskerne opdagede, den marine gastropod Littorina littorea (almindelig periwinkle), som med stor succes har koloniseret de nordatlantiske kyster, har fundet en ejendommelig strategi for endnu mere effektiv afgiftning.
Undersøgelse af de molekylære forskelle mellem proteiner blandt forskellige arter, forskerne løste periwinkle metallothioneins opløsningsstruktur ved hjælp af nuklear magnetisk resonans teknikker og sammenlignede den med andre kendte strukturer og sekvenser. Overraskende, periwinkle's protein består af tre uafhængige domæner, mens andre kendte metallothioniner kun har en eller to. Hver af de tre domæner indeholder ni cysteinrester, der binder en klynge af tre cadmiumioner, således kan de i alt 27 cysteinrester inkorporere ni cadmiumioner. Dette belyser tilpasningsstrategien:"Forøgelse af antallet af domæner øger simpelthen proteinets metalbindingskapacitet og forstærker derved dets metalafgiftningskapacitet, "skrev forfatterne.
Med hensyn til de strukturelle træk, komplekset dannet med cadmium ligner meget det i den romerske snegleform, som effektivt kan skelne mellem de kobberioner, der er vitale for snegle og giftigt cadmium. Og bortset fra simpelthen at klare cadmiumrige miljøer og vælge kobber fra andre tungmetaller, de cysteinrige metallothioniner betragtes som vigtige oxidative-stress-respons-proteiner. Stress er et af de største møder i den almindelige periwinkle, som kan overleve hårdt hav og tørke på samme tid.
 Varme artikler
Varme artikler
-
 Forfølger sikrere, billigere lægemidler via elektromagnetisk kontrol på atomniveauForskningen ledet af Dr. Shoufeng Lan kunne producere sikrere, mindre dyre generiske lægemidler. Kredit:Texas A&M Engineering almindelige lægemidler, såsom ibuprofen, kan bære en iboende fejl i de
Forfølger sikrere, billigere lægemidler via elektromagnetisk kontrol på atomniveauForskningen ledet af Dr. Shoufeng Lan kunne producere sikrere, mindre dyre generiske lægemidler. Kredit:Texas A&M Engineering almindelige lægemidler, såsom ibuprofen, kan bære en iboende fejl i de -
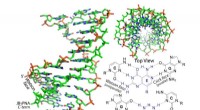 Syntetisk molekyle invaderer dobbeltstrenget DNAUdviklet af forskere ved Carnegie Mellon University, denne janus gamma peptid nukleinsyre (PNA) kan invadere den dobbelte helix af DNA og RNA. Kredit:Carnegie Mellon University Carnegie Mellon Uni
Syntetisk molekyle invaderer dobbeltstrenget DNAUdviklet af forskere ved Carnegie Mellon University, denne janus gamma peptid nukleinsyre (PNA) kan invadere den dobbelte helix af DNA og RNA. Kredit:Carnegie Mellon University Carnegie Mellon Uni -
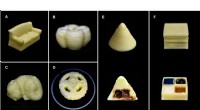 Forskere udvikler en enkel metode til 3-D-print af mælkeprodukterA - D:3D-printede mælkestrukturer af sofa, fæstning, hjul, og kløverblad, henholdsvis. E:3D-printet kegle indeholdende flydende chokoladesirup som internt fyld.F:3D-printet terning med fire rum indeho
Forskere udvikler en enkel metode til 3-D-print af mælkeprodukterA - D:3D-printede mælkestrukturer af sofa, fæstning, hjul, og kløverblad, henholdsvis. E:3D-printet kegle indeholdende flydende chokoladesirup som internt fyld.F:3D-printet terning med fire rum indeho -
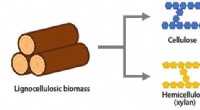 Ny metabolisk ingeniørstrategi forbedrer bioproduktion af polymerråmaterialerFigur 1:Strukturelle komponenter af lignocelluloseholdig biomasse (som ikke konkurrerer med globale fødevareforsyninger). Kredit:Kobe University En forskergruppe, bestående af doktorand Fujiwara R
Ny metabolisk ingeniørstrategi forbedrer bioproduktion af polymerråmaterialerFigur 1:Strukturelle komponenter af lignocelluloseholdig biomasse (som ikke konkurrerer med globale fødevareforsyninger). Kredit:Kobe University En forskergruppe, bestående af doktorand Fujiwara R
- Sådan laver du en 3D-model af Sodium
- Et nyt stetoskop slutter sig til kampen mod antallet af børnelungebetændelse
- NASA forbereder sig på at blive offentliggjort med stille supersonisk teknologi
- Massiv AI Twitter -sonde tegner varmekort over iværksætterpersonlighed
- Hvad er ekvatorerne Latitude?
- Lukning af hullet:Borgervidenskab til overvågning af bæredygtig udvikling


