Hvis 2,14 L -prøve af hydrogenchlorid -HCl -gas ved 2,61 atm og 28 ° C er helt opløst i 668 ml vand til dannelse af saltsyreopløsning Beregn molaritetsopløsningen?
1. Konverter enheder:
* volumen af HCL -gas (L): 2.14 L (allerede i liter)
* tryk på HCL -gas (ATM): 2.61 atm (allerede i atmosfærer)
* Temperatur på HCL -gas (K): 28 ° C + 273,15 =301,15 K
* vandvolumen (L): 668 ml / 1000 ml / l =0,668 l
2. Brug den ideelle gaslov til at finde mol HCL:
* Ideel gaslov: PV =NRT
* P =pres (ATM)
* V =volumen (l)
* n =antal mol
* R =ideel gaskonstant (0,0821 l⋅atm/mol⋅k)
* T =temperatur (k)
* Løs for N (mol HCl):
* N =PV / RT
* n =(2,61 atm) * (2,14 l) / (0,0821 l⋅ATM / mol⋅k) * (301,15 K)
* n ≈ 0,222 mol HCI
3. Beregn molaritet:
* molaritet (m) =mol opløst / liter opløsning
* M =0,222 mol HCI / 0,668 L Opløsning
* m ≈ 0,332 m
Derfor er molariteten af hydrochlorsyreopløsningen ca. 0,332 m.
Sidste artikelNår en syre reagerer med en base, hvilke forbindelser dannes?
Næste artikelHvad er den kemiske formel til lithiumhyponitrit?
 Varme artikler
Varme artikler
-
 Forskere udvikler en bedre metode til at fjerne giftige farvestoffer fra spildevandForskere spinder funktionaliserede nanowebs. Kredit:Texas Tech University Ved at bruge specielt fremstillede nanofiberbaner kan sollys nedbryde farvestofferne sikkert, billigt og nemt. Fra sundhe
Forskere udvikler en bedre metode til at fjerne giftige farvestoffer fra spildevandForskere spinder funktionaliserede nanowebs. Kredit:Texas Tech University Ved at bruge specielt fremstillede nanofiberbaner kan sollys nedbryde farvestofferne sikkert, billigt og nemt. Fra sundhe -
 Forskning afslører første bevis på RNA-udløst faseadskillelseKredit:John Innes Center Et grundlæggende spørgsmål i biologi er, hvordan celler orkestrerer kemiske reaktioner i tid og rum. Membranløse organeller er centrum for mange af disse kemiske reaktion
Forskning afslører første bevis på RNA-udløst faseadskillelseKredit:John Innes Center Et grundlæggende spørgsmål i biologi er, hvordan celler orkestrerer kemiske reaktioner i tid og rum. Membranløse organeller er centrum for mange af disse kemiske reaktion -
 Teknik kunne muliggøre en billigere gødningsproduktionEt fotografi, der viser en model af en elektrokemisk Haber-Bosch-reaktor koblet til en vandelektrolysator, med reaktorerne fremhævet. Kredit:Massachusetts Institute of Technology Det meste af verd
Teknik kunne muliggøre en billigere gødningsproduktionEt fotografi, der viser en model af en elektrokemisk Haber-Bosch-reaktor koblet til en vandelektrolysator, med reaktorerne fremhævet. Kredit:Massachusetts Institute of Technology Det meste af verd -
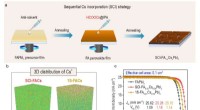 Afkoblingsteknik af formamidinium-cæsiumperovskiter til effektive solceller(a) Skematisk diagram af SCI-FA1-xCsxPbI3 perovskitfilm fremstillet ved afkobling af krystallisationsprocessen af formamidinium og cæsium. (b) 3D distribution af Cs+ i SCI-FA0,91 Cs0.09 PbI3 og 1S-F
Afkoblingsteknik af formamidinium-cæsiumperovskiter til effektive solceller(a) Skematisk diagram af SCI-FA1-xCsxPbI3 perovskitfilm fremstillet ved afkobling af krystallisationsprocessen af formamidinium og cæsium. (b) 3D distribution af Cs+ i SCI-FA0,91 Cs0.09 PbI3 og 1S-F
- Hvad spiser dybt vandfisk?
- Eclipse-visningssikkerhed:Holder dit og dine børns syn sikkert
- NASA-chefen advarer Kongressen om den kinesiske rumstation
- Flod af 'skrammel':Hvordan AI ændrer videnskabelig udgivelse
- Seneste version af Global Aridity Index and Potential Evapotranspiration Database frigivet
- NASA ser kraftige storme med fremadskridende monsun i den Bengalske Bugt


