Hvordan kan det teoretiske udbytte af carbondisulfid beregnes, når 120 g methan reageres med en lige masse svovl?
1. Afbalanceret kemisk ligning:
Den afbalancerede kemiske ligning for reaktionen er:
CH₄ + 4S → CS₂ + 2H₂S
2. Beregn mol af reaktanter:
* mol Ch₄:
- Molmasse CH₄ =12,01 g/mol (C) + 4 * 1,01 g/mol (H) =16,05 g/mol
- mol Ch₄ =120 g / 16,05 g / mol =7,47 mol
* mol af S:
- Molmasse på S =32,07 g/mol
- Mol på S =120 g / 32,07 g / mol =3,74 mol
3. Identificer den begrænsende reaktant:
- Fra den afbalancerede ligning reagerer 1 mol ch₄ med 4 mol S. S.
- Vi har 7,47 mol Ch₄, som kræver 7,47 * 4 =29,88 mol S. S.
- Da vi kun har 3,74 mol s, er svovl den begrænsende reaktant .
4. Beregn teoretisk udbytte af CS₂:
- Den afbalancerede ligning viser, at 4 mol producerer 1 mol CS₂.
- Da vi har 3,74 mol S, kan vi producere 3,74 mol S / 4 =0,935 mol CS₂.
5. Konverter mol CS₂ til gram:
- Molmasse CS₂ =12,01 g/mol (C) + 2 * 32,07 g/mol (s) =76,15 g/mol
- Teoretisk udbytte af CS₂ =0,935 mol * 76,15 g/mol = 71,2 g
Derfor er det teoretiske udbytte af kulstofdisulfid i denne reaktion 71,2 g.
 Varme artikler
Varme artikler
-
 Forskere opdager overkommelig metode til produktion af transparente solcellerIonisk lukket lille-molekyle opv:grænseflade-doping af ladningssamler og transportlag. Kredit: ACS -anvendte materialer og grænseflader (2021). DOI:10.1021/acsami.0c17865 Fysikere fra ITMO Univ
Forskere opdager overkommelig metode til produktion af transparente solcellerIonisk lukket lille-molekyle opv:grænseflade-doping af ladningssamler og transportlag. Kredit: ACS -anvendte materialer og grænseflader (2021). DOI:10.1021/acsami.0c17865 Fysikere fra ITMO Univ -
 Udvikling af fibrilleret cellulose som et bæredygtigt teknologisk materialeKredit:Dr.Hua Xie for University of Maryland, College Park Nanocellulose beklæder planters cellevægge, træer, alger og bakterier bestående af glukoseringe, der kæder sammen som en kæde og giver de
Udvikling af fibrilleret cellulose som et bæredygtigt teknologisk materialeKredit:Dr.Hua Xie for University of Maryland, College Park Nanocellulose beklæder planters cellevægge, træer, alger og bakterier bestående af glukoseringe, der kæder sammen som en kæde og giver de -
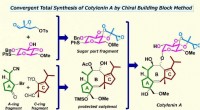 Total syntese af cotylenin A til et nyt kræftlægemiddel uden bivirkningerKredit:Nakada Laboratory, Waseda Universitet Det lykkedes for forskere ved Waseda University at udvikle en metode til en total syntese af cotylenin A, en plantevækstregulator, som har tiltrukket s
Total syntese af cotylenin A til et nyt kræftlægemiddel uden bivirkningerKredit:Nakada Laboratory, Waseda Universitet Det lykkedes for forskere ved Waseda University at udvikle en metode til en total syntese af cotylenin A, en plantevækstregulator, som har tiltrukket s -
 Rapid DNA identificerer ofre for undfangelsesbådbrandKredit:U.S. Department of Homeland Security 34 mennesker døde i en tragisk bådbrand den 2. september. 2019, ud for Santa Cruz Islands kyst, Californien. Fem besætningsmedlemmer slap med skader eft
Rapid DNA identificerer ofre for undfangelsesbådbrandKredit:U.S. Department of Homeland Security 34 mennesker døde i en tragisk bådbrand den 2. september. 2019, ud for Santa Cruz Islands kyst, Californien. Fem besætningsmedlemmer slap med skader eft
- Ingeniørstuderende bruger computermodeller til at hjælpe Smithsonian med at bevare kunsten; finder…
- Superopløsningssystem afslører mekanikken i den lille DNA-walker
- Kinas krig mod forurening viser lovende resultater, undersøgelse finder
- Er det at køre en fysisk videnskab i bilen?
- Hvad er farligt ved mekanisk energi?
- Vil du satse på, at kvinder spiller?


