Kan fosfor eksistere som kovalente krystaller?
Her er hvorfor:
* kovalente krystaller er kendetegnet ved et kontinuerligt netværk af atomer, der afholdes af kovalente bindinger. Dette betyder, at atomerne deler elektroner i en enorm, tredimensionel struktur. Eksempler inkluderer diamant- og siliciumdioxid.
* fosfor Eksisterer i forskellige allotroper (forskellige strukturelle former), men ingen af dem er kovalente krystaller.
* Hvid fosfor (P4) er et molekylært fast stof med diskrete tetrahedrale P4 -molekyler, der holdes sammen af svage van der Waals -kræfter.
* Rød fosfor er en polymerstruktur med kæder af fosforatomer forbundet med kovalente bindinger. Imidlertid er disse kæder ikke kontinuerlige i et tredimensionelt netværk som i kovalente krystaller.
* sort fosfor Har en lagdelt struktur, der ligner grafit, hvor lag af fosforatomer holdes sammen af svagere van der Waals -kræfter.
Selvom fosfor udviser kovalent binding i sine forskellige former, danner den derfor ikke den kontinuerlige netværksstruktur, der er karakteristisk for kovalente krystaller.
 Varme artikler
Varme artikler
-
 Hvordan påvirker strømning kræfter af ladede overflader/partikler og overfladeaktive stoffer i væ…Væskestrøm muliggør mere adsorption. Kredit:© 2020 American Chemical Society Du er på kontoret. Du har skrevet en rapport og trykket på Udskriv. Gå hen til printeren og hent den friske, inkjet-try
Hvordan påvirker strømning kræfter af ladede overflader/partikler og overfladeaktive stoffer i væ…Væskestrøm muliggør mere adsorption. Kredit:© 2020 American Chemical Society Du er på kontoret. Du har skrevet en rapport og trykket på Udskriv. Gå hen til printeren og hent den friske, inkjet-try -
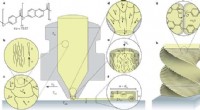 3D-udskrivning hierarkiske flydende krystal-polymerstrukturerUdskrivning af hierarkiske termotrope LCPer ved hjælp af fusioneret deponeringsmodellering. a) korte stavlignende polymerkæder dannet af en aromatisk tilfældig copolymer bestående af de stive monomere
3D-udskrivning hierarkiske flydende krystal-polymerstrukturerUdskrivning af hierarkiske termotrope LCPer ved hjælp af fusioneret deponeringsmodellering. a) korte stavlignende polymerkæder dannet af en aromatisk tilfældig copolymer bestående af de stive monomere -
 Video:Hund vs. maskine:Hvem er en bedre bombedetektor?Kredit:The American Chemical Society Hvad er bedre til at finde en skjult bombe - en hund eller en elektronisk kemikaliedetektor? I denne episode, Reaktionsholdet rejser til U.S. Naval Research L
Video:Hund vs. maskine:Hvem er en bedre bombedetektor?Kredit:The American Chemical Society Hvad er bedre til at finde en skjult bombe - en hund eller en elektronisk kemikaliedetektor? I denne episode, Reaktionsholdet rejser til U.S. Naval Research L -
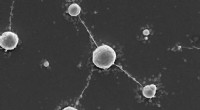 Wolfram som interstellar strålingsafskærmning?Wolfram polyoxometalater som livsopretholdende uorganiske rammer. Enkeltceller af M. sedula efter dyrkning med wolfram-bærende W-POM. Kredit:© Tetyana Milojevic Et kogepunkt på 5900 grader Celsius
Wolfram som interstellar strålingsafskærmning?Wolfram polyoxometalater som livsopretholdende uorganiske rammer. Enkeltceller af M. sedula efter dyrkning med wolfram-bærende W-POM. Kredit:© Tetyana Milojevic Et kogepunkt på 5900 grader Celsius
- Hvor er der solpaneler i verden?
- Undersøgelse opdager lotteri-lignende adfærd på kryptovalutamarkedet
- Blanding af kunstige sødestoffer hæmmer bitter smagsreceptorer
- Rekordmange amerikanere så solformørkelsen i 2017 - og søgte efterfølgende videnskab
- Hvilken er en bedre mulighed for kulstofafgift eller vedvarende energi?
- Hvad er kemikaliet til at rense sorte dollars?


