Hvorfor nitrogen er trivalente elementer?
* Elektronisk konfiguration: Nitrogen har en elektronisk konfiguration af 1S² 2S²2p³. Det har 5 valenselektroner (i 2'erne og 2p orbitaler), der kan deltage i binding.
* Dannelse af obligationer: Kvælstof kan danne kovalente bindinger ved at dele dets valenselektroner med andre atomer.
* Eksempler:
* I ammoniak (NH₃) danner nitrogen tre enkeltbindinger med tre hydrogenatomer og et ensomt par elektroner.
* I salpetersyre (HNO₃) danner nitrogen fire bindinger:en enkelt binding med en hydroxylgruppe (OH), en dobbeltbinding med et iltatom og en koordinat kovalent binding med et andet iltatom.
Hvorfor misforståelsen?
Misforståelsen om, at nitrogen er trivalent, opstår sandsynligvis af det faktum, at det ofte danner tre bindinger, som i ammoniak. Dette betyder dog ikke, at det ikke kan danne mere end tre obligationer.
Key Takeaway: Kvælstof er i stand til at danne op til fem bindinger, hvilket gør det pentavalent, ikke trivalent.
 Varme artikler
Varme artikler
-
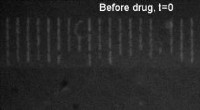 Ny teknik, hvor lægemidler får bakterier til at lyse, kan hjælpe med at bekæmpe antibiotikaresis…Lægemiddeloptagelse i bakterier før og efter. Kredit:Dr Stefano Pagliara, University of Exeter En ny teknik kan hjælpe med at reducere antibiotikaudskrivning ved at forudsige, hvilke lægemidler de
Ny teknik, hvor lægemidler får bakterier til at lyse, kan hjælpe med at bekæmpe antibiotikaresis…Lægemiddeloptagelse i bakterier før og efter. Kredit:Dr Stefano Pagliara, University of Exeter En ny teknik kan hjælpe med at reducere antibiotikaudskrivning ved at forudsige, hvilke lægemidler de -
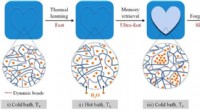 Hydrogel efterligner den menneskelige hjerne med evnen til at huske og glemmeHydrogelens huske-glemmende adfærd opnås baseret på hurtig vandoptagelse (hævelse) ved høj temperatur og langsom vandfrigivelse (krympning) ved lav temperatur, som er muliggjort af dynamiske bindinger
Hydrogel efterligner den menneskelige hjerne med evnen til at huske og glemmeHydrogelens huske-glemmende adfærd opnås baseret på hurtig vandoptagelse (hævelse) ved høj temperatur og langsom vandfrigivelse (krympning) ved lav temperatur, som er muliggjort af dynamiske bindinger -
 Bæredygtig kemisk syntese med platinKilden til phenoler i disse eksperimenter var lignin, som er involveret i de hårde strukturelle komponenter i stive plantekroppe såsom træer. Så træagtig biomasse som denne er det ideelle råmateriale,
Bæredygtig kemisk syntese med platinKilden til phenoler i disse eksperimenter var lignin, som er involveret i de hårde strukturelle komponenter i stive plantekroppe såsom træer. Så træagtig biomasse som denne er det ideelle råmateriale, -
 Ny isomerseparationsmetode er en velsignelse for forskning i proteinoxidationKemikere ved UC Santa Cruz rapporterede om en ny metode til adskillelse af methioninsulfoxiddiastereomerer, der åbner nye muligheder for at studere deres roller i biologiske processer. Kredit:Omslagsk
Ny isomerseparationsmetode er en velsignelse for forskning i proteinoxidationKemikere ved UC Santa Cruz rapporterede om en ny metode til adskillelse af methioninsulfoxiddiastereomerer, der åbner nye muligheder for at studere deres roller i biologiske processer. Kredit:Omslagsk
- Negative effekter af biomasse
- Hvordan løser du remskiven og det faldende spandfysikproblem?
- Kemisk energi er potentialet for?
- De mest sandsynlige produkter dannet fra reaktionen mellem calciumcarbonat og natriummetal?
- Hvad er en strålingsvarme?
- Ville du bruge salt- og sukkerkrystaller til at identificere forskellige farver i en maling?


