Hvad er den molekylære form af PH3 CH4 HCLO N2 CH3NH2 H2CO C2H2 CH3CL HCOOH HCN H2O2?
1. Ph₃ (phosphine)
* form: Trigonal pyramidal
* Ræsonnement: Fosfor har 5 valenselektroner og danner 3 enkeltbindinger med brintatomer og har et ensomt par. Dette fører til en tetrahedral elektrongeometri, men en trigonal pyramidal molekylær form på grund af det ensomme par.
2. CH₄ (Methan)
* form: Tetrahedral
* Ræsonnement: Carbon har 4 valenselektroner og danner 4 enkeltbindinger med brintatomer. Dette fører til en perfekt tetrahedral struktur.
3. HCLO (hypochlorosyre)
* form: Bøjet
* Ræsonnement: Chlor har 7 valenselektroner, ilt har 6, og brint har 1. klor danner en enkelt binding med ilt, og ilt danner en enkelt binding med brint. Klor har 3 ensomme par, og ilt har 2 ensomme par. Dette fører til en tetrahedral elektrongeometri omkring ilt, men en bøjet molekylær form på grund af de ensomme par.
4. N₂ (nitrogengas)
* form: Lineær
* Ræsonnement: Nitrogen har 5 valenselektroner, og hvert nitrogenatom danner en tredobbelt binding med det andet nitrogenatom. Dette fører til en lineær struktur.
5. Ch₃nh₂ (methylamin)
* form: Trigonal pyramidal (omkring nitrogenatomet)
* Ræsonnement: Carbon har 4 valenselektroner og danner 4 enkeltbindinger (3 med brint og 1 med nitrogen). Nitrogen har 5 valenselektroner og danner 3 enkeltbindinger (1 med carbon og 2 med brint) og har 1 ensomt par. Dette fører til en tetrahedral elektrongeometri omkring nitrogen, men en trigonal pyramidal molekylær form på grund af det ensomme par.
6. H₂co (formaldehyd)
* form: Trigonal plan
* Ræsonnement: Carbon har 4 valenselektroner, danner to dobbeltbindinger (en med ilt og en med et carbonatom) og to enkeltbindinger med hydrogenatomer. Dette fører til en trigonal plan geometri.
7. C₂H₂ (acetylen)
* form: Lineær
* Ræsonnement: Carbon har 4 valenselektroner, og hvert carbonatom danner en tredobbelt binding med det andet carbonatom og en enkelt binding med et hydrogenatom. Dette fører til en lineær struktur.
8. CH₃CL (chlormethan)
* form: Tetrahedral
* Ræsonnement: Carbon har 4 valenselektroner og danner 4 enkeltbindinger (3 med brint og 1 med klor). Dette fører til en tetrahedral struktur.
9. Hcooh (myresyre)
* form: Plan (omkring carbonylcarbon) og bøjet (omkring iltatomet)
* Ræsonnement: Carbon har 4 valenselektroner og danner en dobbeltbinding med ilt, en enkelt binding med et andet ilt og en enkelt binding med brint. Oxygen har 6 valenselektroner, danner en enkelt binding med kulstof og har 2 ensomme par. Dette fører til en trigonal plan geometri omkring carbonylcarbonet og en bøjet molekylær form omkring iltatomet.
10. HCN (hydrogencyanid)
* form: Lineær
* Ræsonnement: Carbon har 4 valenselektroner og danner en tredobbelt binding med nitrogen og en enkelt binding med brint. Dette fører til en lineær struktur.
11. H₂O₂ (hydrogenperoxid)
* form: Ikke-plane, hvor hvert iltatom har en bøjet form.
* Ræsonnement: Hvert iltatom har 6 valenselektroner og danner en enkelt binding med et andet iltatom og en enkelt binding med et hydrogenatom. Dette fører til en bøjet form omkring hvert iltatom på grund af tilstedeværelsen af to ensomme par. Det samlede molekyle er ikke-plan på grund af rotationen omkring ilt-iltbindingen.
Sidste artikelHvad indeholder svovl?
Næste artikelHvor mange iltatomer er der i jern?
 Varme artikler
Varme artikler
-
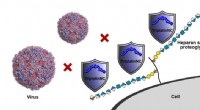 Metalbaserede forbindelser baner vejen for nye antivirale behandlingerTriplatinNC, repræsenteret i blåt, binder sig til celleoverfladereceptorer for at beskytte celler mod virusinfektion (her to enterovirus 71 partikler, repræsenteret til venstre). Kredit:Benjamin Baill
Metalbaserede forbindelser baner vejen for nye antivirale behandlingerTriplatinNC, repræsenteret i blåt, binder sig til celleoverfladereceptorer for at beskytte celler mod virusinfektion (her to enterovirus 71 partikler, repræsenteret til venstre). Kredit:Benjamin Baill -
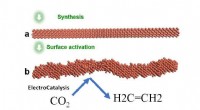 Forskere opdager en effektiv vej til at omdanne kuldioxid til ethylenIllustration af ElectroCatalysis-systemet, som syntetiserede den glatte nanotråd og derefter aktiverede den ved at påføre en spænding for at få den ru trinflade, der er meget selektiv for CO2-reduktio
Forskere opdager en effektiv vej til at omdanne kuldioxid til ethylenIllustration af ElectroCatalysis-systemet, som syntetiserede den glatte nanotråd og derefter aktiverede den ved at påføre en spænding for at få den ru trinflade, der er meget selektiv for CO2-reduktio -
 Nye fund om genbrugscentre for cellerHarald Platta (til venstre) og Fahid Boutouja undersøger de transportprocesser, der foregår i celler. Kredit:© RUB, Marquard Både dyre- og planteceller er afhængige af autofagi, hvor beskadiget el
Nye fund om genbrugscentre for cellerHarald Platta (til venstre) og Fahid Boutouja undersøger de transportprocesser, der foregår i celler. Kredit:© RUB, Marquard Både dyre- og planteceller er afhængige af autofagi, hvor beskadiget el -
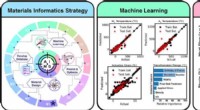 Ny formhukommelseslegering opdaget gennem kunstig intelligens-rammeGrafisk abstrakt. Kredit:Acta Materialia (2022). DOI:10.1016/j.actamat.2022.117751 Forskere fra Department of Materials Science and Engineering ved Texas A&M University har brugt en Artificial Inte
Ny formhukommelseslegering opdaget gennem kunstig intelligens-rammeGrafisk abstrakt. Kredit:Acta Materialia (2022). DOI:10.1016/j.actamat.2022.117751 Forskere fra Department of Materials Science and Engineering ved Texas A&M University har brugt en Artificial Inte
- ATP -syntasen bruger energien fra bevægelige ioner til at kombinere ADP og fosfat, der danner høj …
- Hvordan er producent AC -strøm?
- Hvordan jordskred virker
- Månesten fundet af astronauter stammer sandsynligvis fra Jorden
- Hvad er advangtage af Asextaul -reproduktion?
- Hvilke Dyr i Regnskoven er Scavengers?


