Hvor mange gram svovlsyre er nødvendige for at reagere med 8 mol ammoniumhydroxid?
1. Afbalanceret kemisk ligning
Reaktionen mellem svovlsyre (H₂so₄) og ammoniumhydroxid (NH₄OH) er:
H₂so₄ + 2nh₄oh → (NH₄) ₂SO₄ + 2H₂O
2. Molforhold
Den afbalancerede ligning viser, at 1 mol svovlsyre reagerer med 2 mol ammoniumhydroxid.
3. Beregn mol af svovlsyre
Da vi har 8 mol ammoniumhydroxid, har vi brug for halvdelen af den mængde svovlsyre:
8 mol nh₄oh * (1 mol H₂so₄ / 2 mol nh₄oh) =4 mol H₂so₄
4. Konverter mol til gram
Den molære masse af svovlsyre (H₂so₄) er ca. 98 g/mol.
4 mol H₂so₄ * (98 g/mol) = 392 g H₂so₄
Derfor har du brug for 392 gram svovlsyre for at reagere med 8 mol ammoniumhydroxid.
 Varme artikler
Varme artikler
-
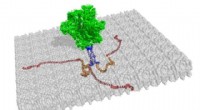 Sidste ukendte struktur af HIV-1 løst, endnu et skridt i bestræbelserne på at afvæbne AIDS -viru…Strukturerne af tre membranassocierede cytoplasmatiske haler af gp41 er vist med rødt og orange, fra denne illustration af den trimeriske spidsstruktur. Resten af dette hiv-1-kuvertprotein, som er f
Sidste ukendte struktur af HIV-1 løst, endnu et skridt i bestræbelserne på at afvæbne AIDS -viru…Strukturerne af tre membranassocierede cytoplasmatiske haler af gp41 er vist med rødt og orange, fra denne illustration af den trimeriske spidsstruktur. Resten af dette hiv-1-kuvertprotein, som er f -
 Grøn brint:Rust som fotoanode og dens grænserRust ville være et ekstremt billigt og stabilt fotoelektrodemateriale til at producere grøn brint med lys. Men effektiviteten er begrænset. TEM-billedet viser en fotoanode indeholdende et tyndt fotoak
Grøn brint:Rust som fotoanode og dens grænserRust ville være et ekstremt billigt og stabilt fotoelektrodemateriale til at producere grøn brint med lys. Men effektiviteten er begrænset. TEM-billedet viser en fotoanode indeholdende et tyndt fotoak -
 RNA grundlæggende byggesten produceret biokatalytisk for første gangGraz-forskerne er de første i verden til at demonstrere YeiN, et enzym, der er en egnet biokatalysator til fremstilling af C-nukleosider, de grundlæggende byggesten i RNA. Kredit:Lunghammer - TU Graz
RNA grundlæggende byggesten produceret biokatalytisk for første gangGraz-forskerne er de første i verden til at demonstrere YeiN, et enzym, der er en egnet biokatalysator til fremstilling af C-nukleosider, de grundlæggende byggesten i RNA. Kredit:Lunghammer - TU Graz -
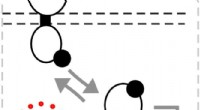 Teknik til at finjustere to-komponent biologiske sensorerKredit:Rice University Rice University-forskere, der siger, at biologiske sensorer ikke er følsomme nok, gør noget ved det. Laboratoriet af syntetisk biolog Jeffrey Tabor har introduceret en ny t
Teknik til at finjustere to-komponent biologiske sensorerKredit:Rice University Rice University-forskere, der siger, at biologiske sensorer ikke er følsomme nok, gør noget ved det. Laboratoriet af syntetisk biolog Jeffrey Tabor har introduceret en ny t
- Hvilken subatomisk partikel gør det muligt at forekomme kemisk binding?
- Hvilken formel relaterer vægt og masse?
- Hvad er brugen af svovl i menneskekroppen?
- Opstår meiose i hver celle i menneskekroppen?
- Når rejser gennem rummet kaldes det stråling?
- Rumstations besætning skal flytte Soyuz, give plads til nye besætningsmedlemmer


