Den slags attraktioner, der resulterer i opløsende natriumchloridvand, er?
De vigtigste attraktioner:
* ioniske bindinger i NaCl: Natriumchlorid er en ionisk forbindelse. Dette betyder, at det holdes sammen af stærke elektrostatiske attraktioner mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
* brintbindinger i vand: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (nær brintatomerne) og en lidt negativ ende (nær iltatomet). Disse modsatte ladninger tillader vandmolekyler at danne hydrogenbindinger med hinanden.
Hvordan opløsning sker:
1. vandmolekyler omgiver ioner: Når NaCl tilsættes til vand, tiltrækkes de polære vandmolekyler af de ladede ioner. De positive ender af vandmolekyler omgiver chloridionerne (Cl-), mens de negative ender omgiver natriumionerne (Na+).
2. Breaking Ionic Bonds: Disse attraktioner mellem vandmolekyler og ioner er stærke nok til at overvinde de ioniske bindinger, der holder NaCl -krystallen sammen.
3. hydrering: Vandmolekylerne "skjuler" ionerne effektivt fra hinanden og holdt dem adskilt og opløst i opløsningen.
Kortfattet:
De attraktioner, der resulterer i opløsning af natriumchlorid i vand, er:
* tiltrækningen mellem de polære vandmolekyler og de ladede ioner af NaCl.
* vandmolekylernes evne til at danne brintbindinger med hinanden.
Disse attraktioner er stærkere end de ioniske bindinger inden for NaCl -krystallen, hvilket fører til dens opløsning.
 Varme artikler
Varme artikler
-
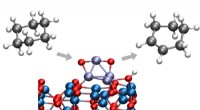 Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved
Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved -
 Nøgleenzymer til syntetisering af naturlige produkterOversigt over den foreslåede biosyntese af bakterielle rubromycin-type polyketider og endelige pathway-produkter. Kredit: Naturkommunikation (2021). DOI:10.1038/s41467-021-21432-9 Planter, svampe
Nøgleenzymer til syntetisering af naturlige produkterOversigt over den foreslåede biosyntese af bakterielle rubromycin-type polyketider og endelige pathway-produkter. Kredit: Naturkommunikation (2021). DOI:10.1038/s41467-021-21432-9 Planter, svampe -
 Belysning af hydrogeler via nanomaterialerDenne visuelle fremstilling demonstrerer, hvordan lys? Reagerende hydrogeler absorberer og konverterer nær-infrarødt lys til varme, som kan udvikles til at styre termoresponsive materialer. Kredit:Dr.
Belysning af hydrogeler via nanomaterialerDenne visuelle fremstilling demonstrerer, hvordan lys? Reagerende hydrogeler absorberer og konverterer nær-infrarødt lys til varme, som kan udvikles til at styre termoresponsive materialer. Kredit:Dr. -
 Solbrændstoffer fungerer godt under pres(Fra l-r) Efstathios Tingas og Wonsik Song diskuterer resultaterne af undersøgelsen med professor Hong Im. Kredit:KAUST Dylan Finol Meget brændstofeffektive nye motordesign kan reducere køretøjers
Solbrændstoffer fungerer godt under pres(Fra l-r) Efstathios Tingas og Wonsik Song diskuterer resultaterne af undersøgelsen med professor Hong Im. Kredit:KAUST Dylan Finol Meget brændstofeffektive nye motordesign kan reducere køretøjers
- Omega Centauri vil sandsynligvis ikke rumme liv
- Hvad omfatter jordteksturer med moderate fysiske og kemiske egenskaber?
- Ny tilgang til at korrigere systematiske fejl i flaskedata for havtemperatur
- Hvilken reaktant i fotosyntesen giver carbonatomerne til at danne glukose?
- Hvor varmt er den hotteste temperatur nogensinde produceret i hele universet?
- Hvordan var de fossile symboler nyttige til at beslutte, hvor de skulle flytte kontinenter?


