Forklar, hvordan det er muligt for brom at have en masse på 79,9 amu på den periodiske tabel, men ikke naturligt forekommende isotop med 80 amu?
* atommasse vs. isotopmasse: Atommassen, der er anført på den periodiske tabel, er et vægtet gennemsnit af masserne af alle naturligt forekommende isotoper af dette element. Det er ikke massen af en enkelt isotop.
* isotoper: Isotoper af et element har det samme antal protoner, men forskellige antal neutroner. Dette betyder, at de har forskellige atommasser.
* Bromes isotoper: Bromin har to hovedisotoper:
* brom-79: Tegner sig for ca. 50,69% af naturligt forekommende brom. Det har 35 protoner og 44 neutroner.
* brom-81: Tegner sig for ca. 49,31% af naturligt forekommende brom. Det har 35 protoner og 46 neutroner.
Hvorfor 79,9 amu?
Atommassen af brom (79,9 amu) beregnes ved at tage det vægtede gennemsnit af masserne af disse to isotoper:
* (0,5069 * 79 amu) + (0,4931 * 81 amu) =79,9 amu
den vigtigste takeaway: Den periodiske tabel viser den gennemsnitlige masse af et element, ikke massen af nogen specifik isotop. Mens brom har isotoper med masser tæt på 79 og 81 amu, er der ikke en naturligt forekommende isotop med nøjagtigt 80 amu.
Sidste artikelHvad er kilder til brint?
Næste artikelAluminiumsulfat reagerer med ammoniumhydroxid for at danne hvad?
 Varme artikler
Varme artikler
-
 Bedragerisk enkel proces kan øge genanvendelsen af plastEva Harth, direktør for Welch-UH Center for Excellence in Polymer Chemistry ved University of Houston, sagde, at den nye metode adresserer et mangeårigt behov for industrielle plastproducenter, uden a
Bedragerisk enkel proces kan øge genanvendelsen af plastEva Harth, direktør for Welch-UH Center for Excellence in Polymer Chemistry ved University of Houston, sagde, at den nye metode adresserer et mangeårigt behov for industrielle plastproducenter, uden a -
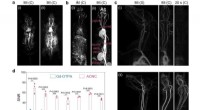 En simpel opskrift på MR-kontraster er op til fire gange højereIn vivo MR angiografi. a, b Kontrastforstærket MR-angiografi (MRA) billeder af hele kroppen på en rotte og b kanin umiddelbart efter bolusinjektionen af (i) Gd-DTPA og (ii) ACNC. c MRA-billeder af o
En simpel opskrift på MR-kontraster er op til fire gange højereIn vivo MR angiografi. a, b Kontrastforstærket MR-angiografi (MRA) billeder af hele kroppen på en rotte og b kanin umiddelbart efter bolusinjektionen af (i) Gd-DTPA og (ii) ACNC. c MRA-billeder af o -
 Opdag, hvad der får durian til at stinkeBillede af en durian. Kredit:Martin Steinhaus Forskere ved Leibniz-Institut for Food Systems Biology ved det tekniske universitet i München (Leibniz-LSB@TUM) har bekræftet tilstedeværelsen af de
Opdag, hvad der får durian til at stinkeBillede af en durian. Kredit:Martin Steinhaus Forskere ved Leibniz-Institut for Food Systems Biology ved det tekniske universitet i München (Leibniz-LSB@TUM) har bekræftet tilstedeværelsen af de -
 Direkte elektrolyse har blandede resultater for udvinding af brændstofkilder fra mikroalgerForskere undersøger måder at forbedre lipidekstraktion fra mikroalger til fremstilling af biobrændstoffer. Kredit:123rf/Akhararat Wathanasing Forskere undersøger måder at forbedre produktionen af
Direkte elektrolyse har blandede resultater for udvinding af brændstofkilder fra mikroalgerForskere undersøger måder at forbedre lipidekstraktion fra mikroalger til fremstilling af biobrændstoffer. Kredit:123rf/Akhararat Wathanasing Forskere undersøger måder at forbedre produktionen af
- Hvordan kan resten af landet forberede sig på naturbrande som dem i Californien?
- Porsche advarer om Brexit -prisstigning på britiske biler
- Bindestreger i papirtitler skader antallet af citater og tidsskriftets indvirkningsfaktorer
- Like Dust in the Wind: A farewell to my March Madness Bracket.
- Tomme bløddyrsskaller rummer historien om evolution, selv for uddøde arter – nu kan vi afkode den
- Gel eller blegning? Forbrugervalg og produktorganisering


