Hvilket oxid kan reduceres til metallet ved hjælp af kulstof?
Hvorfor kulstof fungerer:
* carbon er et godt reduktionsmiddel: Carbon har en stærk affinitet for ilt, hvilket betyder, at det let reagerer med ilt for at danne kuldioxid (CO₂). Denne reaktion fjerner ilt fra metaloxidet.
* Høj temperatur: Processen kræver typisk høje temperaturer for at drive reaktionen fremad.
Eksempler på metaloxider reduceret med kulstof:
* jernoxid (fe₂o₃): Dette er det mest almindelige eksempel, der bruges i produktionen af jern i højovne.
* zinkoxid (ZnO): Brugt til produktion af zinkmetal.
* kobberoxid (CUO): Brugt til produktion af kobbermetal.
* blyoxid (PBO): Brugt til produktion af blymetal.
Generel reaktion:
Den generelle reaktion for carbotermisk reduktion kan repræsenteres som:
`` `
Metaloxid + kulstof → metal + kuldioxid
`` `
specifikt eksempel (jernoxid):
`` `
Fe₂o₃ + 3c → 2Fe + 3Co
`` `
Faktorer, der påvirker reduktion:
* Stabilitet af metaloxidet: Mere stabile metaloxider (f.eks. Aluminiumoxid) kræver højere temperaturer og/eller forskellige reduktionsmidler.
* reaktivitet af kulstof: Forskellige former for kulstof (koks, trækul) har varierende reaktivitet.
* Temperatur: Højere temperaturer favoriserer reduktionsreaktionen.
Fortæl mig, hvis du gerne vil have flere detaljer om ethvert specifikt metaloxid eller processen med carbotermisk reduktion!
 Varme artikler
Varme artikler
-
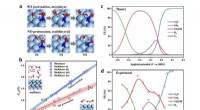 Forskere afslører potentiel afhængighed af nitrogenoxid -elektrisk reduktion til ammoniak(a)-(b) Verifikation af monolagsvandmodel i elektrokatalytiske energibarriereberegninger; (c)-(d) Sammenligning af teoretisk og eksperimentel faradaisk effektivitet. Kredit:LONG Jun Kvælstofoxid (
Forskere afslører potentiel afhængighed af nitrogenoxid -elektrisk reduktion til ammoniak(a)-(b) Verifikation af monolagsvandmodel i elektrokatalytiske energibarriereberegninger; (c)-(d) Sammenligning af teoretisk og eksperimentel faradaisk effektivitet. Kredit:LONG Jun Kvælstofoxid ( -
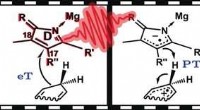 Trinvis hydridoverførsel i biosyntesen af klorofylHydridoverførsel er en vigtig reaktion for kemi (f.eks. brændstofceller), samt biologi (f.eks. respirationskæde og fotosyntese). Tit, en delreaktion involverer overførsel af en hydridion (H−). Men inv
Trinvis hydridoverførsel i biosyntesen af klorofylHydridoverførsel er en vigtig reaktion for kemi (f.eks. brændstofceller), samt biologi (f.eks. respirationskæde og fotosyntese). Tit, en delreaktion involverer overførsel af en hydridion (H−). Men inv -
 Kigger influenza-pandemier i opløbetForskere er ved at udvikle en engangs letanvendelig influenzadetektor, der giver synlige resultater (indsat) på cirka 35 minutter. Kredit:American Chemical Society Truslen om en større influenzapa
Kigger influenza-pandemier i opløbetForskere er ved at udvikle en engangs letanvendelig influenzadetektor, der giver synlige resultater (indsat) på cirka 35 minutter. Kredit:American Chemical Society Truslen om en større influenzapa -
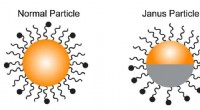 Kemikere skaber en kemisk sonde for bedre at forstå immunresponsOpkaldt efter den to-ansigtede romerske gud, en Janus partikel, ret, er belagt med to separate molekyletyper på tværs af overfladen. Kredit:Lucy Sanchez En trio af kemikere ved Indiana University
Kemikere skaber en kemisk sonde for bedre at forstå immunresponsOpkaldt efter den to-ansigtede romerske gud, en Janus partikel, ret, er belagt med to separate molekyletyper på tværs af overfladen. Kredit:Lucy Sanchez En trio af kemikere ved Indiana University
- NASA øjner kraftig orkan Willa, der påvirker det vestlige Mexico
- Ikke så dyrebart:Fjernelse af guld fra AFM-sonder giver bedre måling af picoskalakræfter
- Hvad er en stjerne i et humørikon?
- Hvad er det konjugerede par for en stærk base?
- Hvorfor blev den menneskelige race skabt?
- Hvilke makromolekyler giver den mest mængde energi pr. Gram?


