Former et metallisk element en syre eller base, når den reagerer med vand?
* Metallisk karakter: Metaller har en tendens til at miste elektroner let og dannes positivt ladede ioner (kationer).
* reaktion med vand: Når et metal reagerer med vand, mister det typisk elektroner til brintatomerne i vandmolekyler. Dette resulterer i dannelsen af hydroxidioner (OH-), som er basale.
* Eksempel: Natrium (NA) reagerer med vand for at producere natriumhydroxid (NaOH), en stærk base:
2NA (S) + 2H₂O (L) → 2NAOH (AQ) + H₂ (G)
Undtagelser:
* ædle metaller: Metaller som guld (AU) og platin (PT) er meget ureaktive og reagerer ikke med vand.
* Nogle overgangsmetaller: Visse overgangsmetaller som kobber (Cu) og sølv (Ag) reagerer meget langsomt med vand og kan danne oxider snarere end baser.
Vigtig note: Metallers reaktivitet med vand varierer meget. Nogle metaller som natrium og kalium reagerer voldsomt, mens andre kan lide jern reagerer langsomt. Reaktiviteten bestemmes af metalens position i reaktivitetsserien.
 Varme artikler
Varme artikler
-
 Gør som et blad:Forskere udvikler metode til at omdanne kuldioxidKredit:CC0 Public Domain Professor Jun Huang fra University of Sydneys School of Chemical and Biomolecular Engineering er ved at udvikle en kulstoffangstmetode, der sigter mod at gå et skridt ud o
Gør som et blad:Forskere udvikler metode til at omdanne kuldioxidKredit:CC0 Public Domain Professor Jun Huang fra University of Sydneys School of Chemical and Biomolecular Engineering er ved at udvikle en kulstoffangstmetode, der sigter mod at gå et skridt ud o -
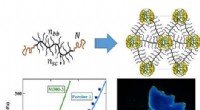 Polymerer, der efterligner kamæleons hudØverst til venstre:molekylær struktur af en plastomer syntetiseret i dette værk; højre:supramolekylær struktur dannet ved samling af identiske plastomerer. Nederst-til venstre:belastningskurver til pl
Polymerer, der efterligner kamæleons hudØverst til venstre:molekylær struktur af en plastomer syntetiseret i dette værk; højre:supramolekylær struktur dannet ved samling af identiske plastomerer. Nederst-til venstre:belastningskurver til pl -
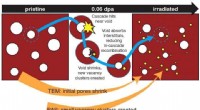 Ikke-destruktive positronstråler sondeskade, understøtte sikkerhedsfremskridt i strålingsmiljøerEn kombination af positron-annihilationsspektroskopi og transmissionselektronmikroskopi afslører ny indsigt i, hvordan skader dannes i bestrålede materialer, foreslår en mekanisme, hvor store huller i
Ikke-destruktive positronstråler sondeskade, understøtte sikkerhedsfremskridt i strålingsmiljøerEn kombination af positron-annihilationsspektroskopi og transmissionselektronmikroskopi afslører ny indsigt i, hvordan skader dannes i bestrålede materialer, foreslår en mekanisme, hvor store huller i -
 Bevis for vandledninger motiveret af en biologisk vandkanalDetaljer om en vandtråd (central kanal) indlejret i en selvsamlet immidazolkanal (blå) i et lipid-dobbeltlag. Summeringen af hændelsen synlige (grønne) og IR (røde) stråler producerer en resulterend
Bevis for vandledninger motiveret af en biologisk vandkanalDetaljer om en vandtråd (central kanal) indlejret i en selvsamlet immidazolkanal (blå) i et lipid-dobbeltlag. Summeringen af hændelsen synlige (grønne) og IR (røde) stråler producerer en resulterend
- Kun en kraft virker på et objekt kan have nul acceleration eller hastighed?
- Retningslinjer for en-nanometer magnetisk tunnelforbindelsesteknologi
- Er cirrus- eller stratusskyer fra over 6000 meter?
- Forskere efterligner naturen for at konstruere nanofilm
- Forskere finder en sandsynlig kilde til metan på Mars
- Er konstellationer kun synlige i bestemte sæsoner på grund af Jordens revolution mod konstellation…


