Hvorfor giver tørt natriumchlorid og nitratens opløsninger alle samme farve til flamme?
Her er hvorfor:
* excitation og emission: Når du opvarmer natriumsalte i en flamme, begejstrer energien fra varmen natriumatomerne. Dette betyder, at elektronerne i natriumatomerne hopper til højere energiniveau.
* Energiudgivelse: Når disse ophidsede elektroner vender tilbage til deres jordtilstand (lavere energiniveau), frigiver de energi i form af lys.
* bølgelængde og farve: Energien frigivet af natriumatomer svarer til en bestemt bølgelængde af lys, der falder i den gule del af det synlige spektrum.
Derfor er den gule farve karakteristisk for natriumioner (NA⁺) og ikke specifik for anionen, der er til stede i forbindelsen.
Dette er et meget nyttigt fænomen i kemi. Flammetest bruges til at identificere tilstedeværelsen af visse elementer i en prøve baseret på den farve, de producerer, når de opvarmes i en flamme.
 Varme artikler
Varme artikler
-
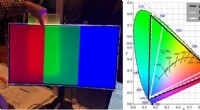 Oprettelse af skærme med rigere farver(Venstre) Foto, der viser farveforbedringseffekten ved brug af en prototype af den perovskitbaserede film. Når filmen placeres mellem baggrundsbelysningsenheden og skærmen, en spektral renere rød og g
Oprettelse af skærme med rigere farver(Venstre) Foto, der viser farveforbedringseffekten ved brug af en prototype af den perovskitbaserede film. Når filmen placeres mellem baggrundsbelysningsenheden og skærmen, en spektral renere rød og g -
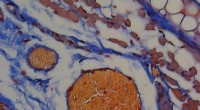 Ved hjælp af lys, røde blodlegemer og et honningbipeptid til at levere terapeutiske proteinerEt orange-rødt farvestof viser, at der dannes blodpropper i et musøre, hvor thrombin blev frigivet fra lysudløste RBCer. Skala bar, 50 μm. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/
Ved hjælp af lys, røde blodlegemer og et honningbipeptid til at levere terapeutiske proteinerEt orange-rødt farvestof viser, at der dannes blodpropper i et musøre, hvor thrombin blev frigivet fra lysudløste RBCer. Skala bar, 50 μm. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/ -
 Afsløring af, hvad der styrer krystalvækstSkematisk af mikrostråleoverfladerøntgenspredning under vækst af galliumnitridkrystal ved høj temperatur. Kredit:Argonne National Laboratory. Med strålende farver og maleriske former, mange krysta
Afsløring af, hvad der styrer krystalvækstSkematisk af mikrostråleoverfladerøntgenspredning under vækst af galliumnitridkrystal ved høj temperatur. Kredit:Argonne National Laboratory. Med strålende farver og maleriske former, mange krysta -
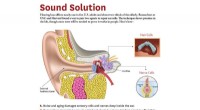 Tilslutning af hørehjælpemolekyler til øreknoglenKredit:USC Forskere ved USC og Harvard har udviklet en ny tilgang til at reparere celler dybt inde i øret - et potentielt middel, der kan genoprette hørelsen for millioner af ældre mennesker og an
Tilslutning af hørehjælpemolekyler til øreknoglenKredit:USC Forskere ved USC og Harvard har udviklet en ny tilgang til at reparere celler dybt inde i øret - et potentielt middel, der kan genoprette hørelsen for millioner af ældre mennesker og an
- Sådan adskilles en blanding af Sand & Salt
- Sådan træner du din hund i grundlæggende livsfærdigheder, og hvorfor det er vigtigt
- Livets oprindelse indsigt:peptider kan dannes uden aminosyrer
- 10 ting, vi troede var sande før den videnskabelige metode
- Hvilken dannelse er en glat bakke dannet af stenet affald, der er efterladt ved at smelte gletsjer?
- Hvilken af de store observatorier var den første, der blev lanceret, og indsamler stadig oplysnin…


