Hvorfor skulle du forvente, at en 1,5 M CaCl2 -opløsning har lavere frysepunkt end NaCl -opløsning?
Frysningspunktdepression og kolligative egenskaber
* Kolligative egenskaber: Dette er egenskaber ved løsninger, der kun afhænger af * koncentrationen * af opløste partikler, ikke deres identitet. Frysepunktdepression er en sådan egenskab.
* frysningspunktdepression: Frysningspunktet for et opløsningsmiddel sænkes, når et opløst stof opløses i det. Jo større koncentration af opløste partikler er, jo større er depressionen.
Dissociation
* NaCl: Natriumchlorid (NaCl) adskiller sig i to ioner i opløsning:Na⁺ og Cl⁻. Så en 1,5 M NaCl -opløsning vil have 3,0 m af de samlede ioner (1,5 m Na⁺ + 1,5 m cl⁻).
* cacl₂: Calciumchlorid (cacl₂) adskiller sig i tre ioner i opløsning:Ca²⁺ og 2Cl⁻. Derfor vil en 1,5 M CaCl₂ -opløsning have 4,5 m af de samlede ioner (1,5 m Ca²⁺ + 3,0 m cl⁻).
Den vigtigste forskel
Fordi cacl₂ producerer flere ioner i opløsning end NaCI ved den samme molalitet, vil det have en større effekt på at sænke frysepunktet.
Kortfattet
1,5 M CaCl₂ -opløsningen vil have et lavere frysepunkt end 1,5 M NaCl -opløsningen, fordi den producerer en højere koncentration af opløste partikler, hvilket fører til en større depression af frysepunktet.
Sidste artikelEr H2O et atom eller molekyle?
Næste artikelHvilken forbindelse skaber kulstofhydrogen og ilt?
 Varme artikler
Varme artikler
-
 En økonomisk legeringsbaseret aerogel som elektrokatalysator til carbonfikseringKredit:Wiley Mange industrielle processer udsender kuldioxid til atmosfæren. Desværre, imidlertid, nuværende elektrokemiske adskillelsesmetoder er dyre og forbruger store mængder strøm. De kræver
En økonomisk legeringsbaseret aerogel som elektrokatalysator til carbonfikseringKredit:Wiley Mange industrielle processer udsender kuldioxid til atmosfæren. Desværre, imidlertid, nuværende elektrokemiske adskillelsesmetoder er dyre og forbruger store mængder strøm. De kræver -
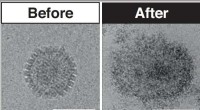 Unik ny antiviral behandling fremstillet ved hjælp af sukkerVirucidbehandling før og efter. Kredit:University of Manchester Nye antivirale materialer fremstillet af sukker er udviklet til at ødelægge vira ved kontakt og kan hjælpe i kampen mod virusudbrud.
Unik ny antiviral behandling fremstillet ved hjælp af sukkerVirucidbehandling før og efter. Kredit:University of Manchester Nye antivirale materialer fremstillet af sukker er udviklet til at ødelægge vira ved kontakt og kan hjælpe i kampen mod virusudbrud. -
 Enzym -actionfilm viser, hvordan naturen laver penicillinerKredit:CC0 Public Domain Forskere, der er specialiserede i at studere atom-for-atom-koreografi af enzymer, har afsløret ny indsigt i funktionen af isopenicillin N-syntase, et enzym, der er nødve
Enzym -actionfilm viser, hvordan naturen laver penicillinerKredit:CC0 Public Domain Forskere, der er specialiserede i at studere atom-for-atom-koreografi af enzymer, har afsløret ny indsigt i funktionen af isopenicillin N-syntase, et enzym, der er nødve -
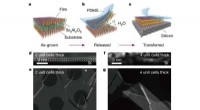 Forskere finder en måde at producere fritstående film af perovskitoxiderVækst og overførsel af ultratynde fritstående SrTiO3 -film. en, Skematisk af en film med et SAO -bufferlag. b, Det opofrende SAO -lag opløses i vand for at frigive de øverste oxidfilm med mekanisk und
Forskere finder en måde at producere fritstående film af perovskitoxiderVækst og overførsel af ultratynde fritstående SrTiO3 -film. en, Skematisk af en film med et SAO -bufferlag. b, Det opofrende SAO -lag opløses i vand for at frigive de øverste oxidfilm med mekanisk und
- Hvilken blanding af gasser menes at have sammensat Jorden?
- Hvilken rolle spiller Magma i rockcyklussen?
- Hvordan har forståelsen af elektricitet ændret sig over tid?
- Hvad er den elektroniske struktur af svovl?
- Hvad er forholdet mellem et gen og en allelstruktur af DNA -molekyle?
- Ny kulstof nanorørsensor kan registrere små spor af sprængstoffer


