Hvad er densiteten af bromdamp ved STP?
1. Forstå STP
STP står for standardtemperatur og tryk:
* Temperatur: 0 ° C (273,15 K)
* tryk: 1 atm (101.325 kPa)
2. Ideel gaslov
Vi kan bruge den ideelle gaslov til at relatere tætheden af en gas til dens molære masse og andre tilstande:
* PV =NRT
* P =pres (ATM)
* V =volumen (l)
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (k)
3. Omarranger for densitet
Densitet (ρ) er masse (m) pr. Enhedsvolumen (v):
* ρ =m/v
Vi kan omskrive den ideelle gaslov til at løse for densitet:
* ρ =(n * m) / v
* M =molær masse af gassen (g/mol)
Udskiftning af den ideelle gaslov (PV =NRT) med 'N' i densitetsligningen:
* ρ =(pm) / (rt)
4. Beregn densiteten af bromdamp
* Molær masse af brom (br₂): 79,904 g/mol * 2 =159,808 g/mol
* tryk (p): 1 atm
* temperatur (t): 273,15 K.
* Ideel gaskonstant (R): 0,0821 L · atm/mol · k
erstatte værdierne i ligningen:
* ρ =(1 atm * 159,808 g/mol)/(0,0821 l · atm/mol · k * 273,15 K)
* ρ ≈ 7,14 g/l
Derfor er densiteten af bromdamp ved STP ca. 7,14 g/l.
Sidste artikelHvor mange atomer af ilt er der i 2ai2o3?
Næste artikelHvad er det rigtige navn på en vandig løsning af HCL?
 Varme artikler
Varme artikler
-
 Udfiskning af de dårlige æbler:Ny kvantitativ metode til at vurdere fødevaresikkerhedenForkælet mad, især fisk, kan have høje niveauer af histamin, som kan være farligt for mennesker; dermed, det er vigtigt at udtænke metoder til påvisning af sådanne skadelige kemikalier i fødevarer Kre
Udfiskning af de dårlige æbler:Ny kvantitativ metode til at vurdere fødevaresikkerhedenForkælet mad, især fisk, kan have høje niveauer af histamin, som kan være farligt for mennesker; dermed, det er vigtigt at udtænke metoder til påvisning af sådanne skadelige kemikalier i fødevarer Kre -
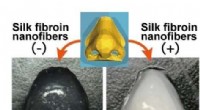 Silkefibre forbedrer bioink til 3D-trykte kunstige væv og organerFigur. 3D-printede konstruktioner ved hjælp af hyaluronsyre-baseret blæk fri for silke fibroin nanofibre (-) og indeholdende silke fibroin nanofibre (+). Kredit:Osaka University Hvordan tester du,
Silkefibre forbedrer bioink til 3D-trykte kunstige væv og organerFigur. 3D-printede konstruktioner ved hjælp af hyaluronsyre-baseret blæk fri for silke fibroin nanofibre (-) og indeholdende silke fibroin nanofibre (+). Kredit:Osaka University Hvordan tester du, -
 Forskere kaster nyt lys over molekylær adfærdKredit:CC0 Public Domain Forskere ved Heriot-Watt University har udviklet et nyt eksperiment, der har afsløret aldrig før set molekylær adfærd. Et team af forskere ledet af professor Matt Costen
Forskere kaster nyt lys over molekylær adfærdKredit:CC0 Public Domain Forskere ved Heriot-Watt University har udviklet et nyt eksperiment, der har afsløret aldrig før set molekylær adfærd. Et team af forskere ledet af professor Matt Costen -
 Potentialet for ikke-giftige materialer til at erstatte bly i perovskit-solcellerDet er stadig en udfordring at udskifte bly med mindre giftige materialer i perovskit -solceller uden at gå på kompromis med ydeevnen. Kredit:Tsinghua University og LeadVanced PV Co., Ltd At udvik
Potentialet for ikke-giftige materialer til at erstatte bly i perovskit-solcellerDet er stadig en udfordring at udskifte bly med mindre giftige materialer i perovskit -solceller uden at gå på kompromis med ydeevnen. Kredit:Tsinghua University og LeadVanced PV Co., Ltd At udvik
- For at drive AI fremad, lære computere at spille gammeldags teksteventyrspil
- Hvad er en atomkædereaktion?
- Hvad er bøjningen af en bølge, når den bevæger sig fra et materiale til andet?
- Typer af observation i den videnskabelige metode
- Forskere:Sierra Nevada er hjemsted for det ældste underjordiske vandpåfyldningssystem i Europa
- Når en bølge skifter hastighed, når den kommer ind i nyt medium, gennemgår diffraktion?


