Hvad er forskellen mellem oxidation og dehydrogenationsmidler?
Oxidation
* Definition: En kemisk proces, hvor et stof mister elektroner, hvilket resulterer i en stigning i dets oxidationstilstand.
* mekanisme: Involverer forstærkning af iltatomer eller tab af brintatomer.
* Eksempler:
* Rusten af jern:Fe + O₂ → Fe₂o₃ (jern mister elektroner og oxideres)
* Brænding af brændstoffer:C + O₂ → CO₂ (Carbon mister elektroner og oxideres)
* agenter: Oxidationsmidler er stoffer, der får elektroner og forårsager oxidation i et andet stof. Almindelige eksempler inkluderer:
* Ilt (o₂)
* Kaliumpermanganat (kmno₄)
* Kromsyre (h₂cro₄)
dehydrogenering
* Definition: En kemisk proces, hvor et stof mister hydrogenatomer.
* mekanisme: Involverer typisk fjernelse af hydrogenatomer fra et molekyle, ofte af en katalysator.
* Eksempler:
* Konvertering af ethan til ethen:C₂H₆ → C₂H₄ + H₂ (Ethan mister hydrogenatomer og er dehydrogeneret)
* Dannelse af benzen fra cyclohexan:C₆H₁₂ → C₆H₆ + 3H₂ (Cyclohexane mister hydrogenatomer og er dehydrogeneret)
* agenter: Dehydrogenationsmidler er stoffer, der fremmer fjernelse af brintatomer. Disse kan være:
* Katalysatorer som platin (PT), nikkel (NI) eller Palladium (PD)
* Specifikke reagenser som quinones
Nøgleforskelle
* fokus: Oxidation fokuserer på elektronab, mens dehydrogenering fokuserer på brinttab.
* mekanisme: Oxidation kan involvere iltforstærkning eller brinttab, mens dehydrogenering strengt involverer brinttab.
* Resultat: Oxidation resulterer ofte i dannelse af oxider, mens dehydrogenering typisk fører til dannelse af umættede forbindelser.
Kortfattet:
* Oxidation er et bredere koncept, der omfatter elektronab.
* Dehydrogenering er en specifik type oxidation, der fokuserer på hydrogenatomtab.
Det er vigtigt at bemærke, at dehydrogenering er en type oxidation, men ikke alle oxidationer er dehydrogenationer.
Sidste artikelHvad er KSP for aluminiumshydroxid?
Næste artikelEr jernsulfat mere reaktivt end sølvnitrat?
 Varme artikler
Varme artikler
-
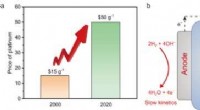 Billige legeringer konkurrerer med dyrt platin for at booste brændselscellerDen venstre figur viser platinpristendenserne over de seneste to årtier, og den højre figur forklarer alternativet:anionbyttermembranbrændselsceller (AEMFCer). Kredit:QIN Shuai et al. Som den rene
Billige legeringer konkurrerer med dyrt platin for at booste brændselscellerDen venstre figur viser platinpristendenserne over de seneste to årtier, og den højre figur forklarer alternativet:anionbyttermembranbrændselsceller (AEMFCer). Kredit:QIN Shuai et al. Som den rene -
 Elektrokemi skyller antibiotikaresistente proteiner udKredit:EPFL Alain Herzog /Yingdi Zhu, Horst Pick EPFL-forskere, arbejder i samarbejde med Valais Hospital i Sion og Fudan University i Shanghai, har udviklet en metode til at analysere bakterier,
Elektrokemi skyller antibiotikaresistente proteiner udKredit:EPFL Alain Herzog /Yingdi Zhu, Horst Pick EPFL-forskere, arbejder i samarbejde med Valais Hospital i Sion og Fudan University i Shanghai, har udviklet en metode til at analysere bakterier, -
 Forskere identificerer enzym, der er ansvarligt for at hjælpe kræfttumorer med at sprede sigSteven Van Doren afslørede, hvordan et kræftkritisk enzym er placeret på celleoverflader. Kredit:University of Missouri-Columbia Forskere ved University of Missouri har opdaget, hvordan et kræftkr
Forskere identificerer enzym, der er ansvarligt for at hjælpe kræfttumorer med at sprede sigSteven Van Doren afslørede, hvordan et kræftkritisk enzym er placeret på celleoverflader. Kredit:University of Missouri-Columbia Forskere ved University of Missouri har opdaget, hvordan et kræftkr -
 Ultralet materiale modstår supersoniske mikropartikelpåvirkningerIngeniører ved MIT, Caltech, og ETH Zürich finder nanoarkitekterede materialer designet ud fra præcist mønstrede nanoskalastrukturer (billedet) kan være en lovende vej til letvægtsrustning, beskyttend
Ultralet materiale modstår supersoniske mikropartikelpåvirkningerIngeniører ved MIT, Caltech, og ETH Zürich finder nanoarkitekterede materialer designet ud fra præcist mønstrede nanoskalastrukturer (billedet) kan være en lovende vej til letvægtsrustning, beskyttend
- Hvad får de tektoniske plader til at bevæge sig?
- Store resultater fra små partikler
- Fortæl dig nogle apllikationer af rullende friktion?
- Hvilke underniveauer er besat i det yderste principenerginiveau i en argonatom jordtilstand?
- Hvilken er en af stjernerne i Constellation Orion som stor kredsløb Saturn?
- Hvilket land strækker sig længst nord længere vest?


