Hvad er KSP for aluminiumshydroxid?
Her er en sammenbrud af, hvad KSP repræsenterer, og hvordan det gælder for aluminiumshydroxid:
* KSP (opløselighedsproduktkonstant): Dette er en ligevægtskonstant, der beskriver opløseligheden af en sparsomt opløselig ionisk forbindelse i vand. Det er i det væsentlige et mål for, hvor meget af forbindelsen der kan opløses, før opløsningen bliver mættet.
* opløselighed af aluminiumhydroxid: Al (OH) ₃ er en meget sparsomt opløselig forbindelse, hvilket betyder, at den ikke opløses meget i vand.
* ligevægtsreaktion: Når Al (OH) ₃ opløses, adskiller den sig til aluminiumioner (al³⁺) og hydroxidioner (OH⁻):
AL (OH) ₃ (S) ⇌ al³⁺ (aq) + 3OH⁻ (aq)
* KSP -ekspression: KSP for AL (OH) ₃ udtrykkes som:
Ksp =[al³⁺] [oh⁻] ³
Hvor:
* [Al³⁺] er den molære koncentration af aluminiumioner i en mættet opløsning
* [OH⁻] er den molære koncentration af hydroxidioner i en mættet opløsning
Derfor indikerer værdien af KSP =2 x 10⁻³², at hydroxid af aluminium er ekstremt uopløselig i vand.
 Varme artikler
Varme artikler
-
 Forskere afkoder dynamikken i den største proteinnedbrydende maskine i atomare detaljerKredit:CC0 Public Domain Protein nanomaskiner lavet af flere proteinmolekyler er meget dynamiske under deres handlinger på deres funktionelle mål, nogle gange kaldet substrater. Dynamikken af di
Forskere afkoder dynamikken i den største proteinnedbrydende maskine i atomare detaljerKredit:CC0 Public Domain Protein nanomaskiner lavet af flere proteinmolekyler er meget dynamiske under deres handlinger på deres funktionelle mål, nogle gange kaldet substrater. Dynamikken af di -
 Forskere udnytter carbenernes kraft til at fremstille stoffer nemmere og mere sikkertKredit:CC0 Public Domain På trods af at de er nogle af de mest alsidige byggesten i organisk kemi, kan forbindelser kaldet carbener være for varme til at håndtere. I laboratoriet undgår kemikere of
Forskere udnytter carbenernes kraft til at fremstille stoffer nemmere og mere sikkertKredit:CC0 Public Domain På trods af at de er nogle af de mest alsidige byggesten i organisk kemi, kan forbindelser kaldet carbener være for varme til at håndtere. I laboratoriet undgår kemikere of -
 Ved at opdage genetisk materiale, hurtig sensor har potentiel anvendelse som et klinisk værktøj3D-model af DNA. Kredit:Michael Ströck/ Wikimedia/ GNU Free Documentation License På mindre end et sekund, en lille sensor, der bruges i hjernekemiforskning, kan detektere nøglemolekylerne, der gi
Ved at opdage genetisk materiale, hurtig sensor har potentiel anvendelse som et klinisk værktøj3D-model af DNA. Kredit:Michael Ströck/ Wikimedia/ GNU Free Documentation License På mindre end et sekund, en lille sensor, der bruges i hjernekemiforskning, kan detektere nøglemolekylerne, der gi -
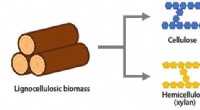 Ny metabolisk ingeniørstrategi forbedrer bioproduktion af polymerråmaterialerFigur 1:Strukturelle komponenter af lignocelluloseholdig biomasse (som ikke konkurrerer med globale fødevareforsyninger). Kredit:Kobe University En forskergruppe, bestående af doktorand Fujiwara R
Ny metabolisk ingeniørstrategi forbedrer bioproduktion af polymerråmaterialerFigur 1:Strukturelle komponenter af lignocelluloseholdig biomasse (som ikke konkurrerer med globale fødevareforsyninger). Kredit:Kobe University En forskergruppe, bestående af doktorand Fujiwara R


