Er jernsulfat mere reaktivt end sølvnitrat?
* Aktivitetsserie: Metaller er arrangeret i en serie baseret på deres reaktivitet. Metaller, der er højere i serien, er mere reaktive end de lavere nede. Jern (Fe) er højere i aktivitetsserien end sølv (AG).
* forskydningsreaktioner: Et mere reaktivt metal kan fortrænge et mindre reaktivt metal fra dets forbindelse i en enkelt forskydningsreaktion. For eksempel:
* feso₄ + 2agno₃ → Fe (no₃) ₂ + 2Ag
I denne reaktion fortrænger jern (Fe) fra jernsulfat sølv (Ag) fra sølvnitrat, danner jernnitrat og metallisk sølv. Denne reaktion demonstrerer den højere reaktivitet af jern.
Yderligere faktorer:
* opløselighed: Jernsulfat er generelt mere opløseligt i vand end sølvnitrat. Dette betyder, at det er mere sandsynligt, at det er til stede i en form, der let kan reagere.
* Oxidationstilstand: Jernet i jernholdigt sulfat er i +2 oxidationstilstand, som er en relativt stabil tilstand, men det kan oxideres yderligere til +3. Sølv i sølvnitrat er allerede i sin højeste oxidationstilstand (+1), hvilket gør det mindre sandsynligt, at det reagerer.
Kortfattet: Jernsulfat betragtes som mere reaktiv end sølvnitrat på grund af dets højere position i aktivitetsserien, dets tendens til at deltage i forskydningsreaktioner og dets generelt større opløselighed.
Sidste artikelHvad er forskellen mellem oxidation og dehydrogenationsmidler?
Næste artikelHvor mange svovlatomer er der i 78,4 gram svovl?
 Varme artikler
Varme artikler
-
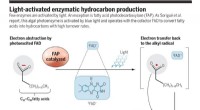 Et algenfotoenzym, der bruger blåt lys til at omdanne fedtsyrer til kulbrinterLysaktiveret enzymatisk kulbrinteproduktion. Kredit:(c) A. Kitterman / Videnskab , DOI:10.1126/science.aao4399 (Phys.org) - Et team af forskere tilknyttet flere institutioner i Frankrig har opda
Et algenfotoenzym, der bruger blåt lys til at omdanne fedtsyrer til kulbrinterLysaktiveret enzymatisk kulbrinteproduktion. Kredit:(c) A. Kitterman / Videnskab , DOI:10.1126/science.aao4399 (Phys.org) - Et team af forskere tilknyttet flere institutioner i Frankrig har opda -
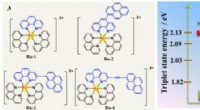 Finjustering af den exciterede tilstand af Ru(II)-fotosensibilisatorer til at øge kuldioxidomdannel…(Venstre) Molekylær struktur af Ru-1-Ru-4. (Højre) Energidiagram over triplettilstande af Ru-1, og L-2-L-4. Kredit:©Science China Press Soldrevet reduktion af CO 2 til energirige brændstoffer, s
Finjustering af den exciterede tilstand af Ru(II)-fotosensibilisatorer til at øge kuldioxidomdannel…(Venstre) Molekylær struktur af Ru-1-Ru-4. (Højre) Energidiagram over triplettilstande af Ru-1, og L-2-L-4. Kredit:©Science China Press Soldrevet reduktion af CO 2 til energirige brændstoffer, s -
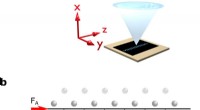 Laserkølede ioner bidrager til bedre forståelse af friktiona) 30 ytterbium-ioner fanges i en lineær radiofrekvensfælde. Laser 1 bestråler hele krystallen og får den til at fluorescere. Dette lys opsamles ved hjælp af et objektiv i høj opløsning og afbildes på
Laserkølede ioner bidrager til bedre forståelse af friktiona) 30 ytterbium-ioner fanges i en lineær radiofrekvensfælde. Laser 1 bestråler hele krystallen og får den til at fluorescere. Dette lys opsamles ved hjælp af et objektiv i høj opløsning og afbildes på -
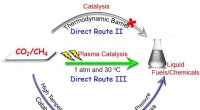 Gennembrud i direkte aktivering af CO2 og CH4 til flydende brændstoffer og kemikalierDirekte omdannelse af CO 2 og CH 4 til flydende brændstoffer. Kredit:University of Liverpool Forskere fra University of Liverpool har gjort et betydeligt gennembrud i den direkte omdannelse af
Gennembrud i direkte aktivering af CO2 og CH4 til flydende brændstoffer og kemikalierDirekte omdannelse af CO 2 og CH 4 til flydende brændstoffer. Kredit:University of Liverpool Forskere fra University of Liverpool har gjort et betydeligt gennembrud i den direkte omdannelse af
- Hvad er spredningsproces?
- Oversvømmelsesopkøb gavner uforholdsmæssigt meget de hvideste udsatte kvarterer i byerne
- Hvordan påvirker lys temperaturen på et objekt?
- Hvad er unifom hastighed?
- Indien forurening vagthund bøder Delhi for giftig smog
- Enkel teknik giver mulighed for nøjagtige computersimuleringer af calciumsignalering


