Hydrogen og helium er ideelle gasser ved almindeligt tryk i stuetemperatur, men svovldioxid er ikke en gas?
* Ideelle gasforudsætninger: Ideelle gasser er teoretiske konstruktioner, der følger specifikke regler:
* ubetydelige intermolekylære kræfter: Partikler i ideelle gasser interagerer ikke med hinanden, hvilket betyder, at de ikke har nogen tiltrækning eller frastødelse.
* ubetydelig partikelvolumen: Gaspartiklernes volumen er ubetydelig sammenlignet med beholderens volumen.
* Hvorfor svovldioxid afviger: Svovldioxidmolekyler er polære (har en positiv og negativ ende), hvilket fører til stærkere intermolekylære kræfter (dipol-dipolinteraktioner) sammenlignet med brint og helium. Disse kræfter får molekylerne til at holde sig sammen, påvirke deres opførsel og få dem til at afvige fra ideel gasadfærd.
Kortfattet:
* brint og helium: Disse elementer findes som enkeltatomer, som er ikke -polære og har ekstremt svage intermolekylære kræfter. Dette gør dem tættere på ideel gasadfærd ved stuetemperatur og tryk.
* svovldioxid: På grund af dens polaritet og stærkere intermolekylære kræfter afviger svovldioxid fra ideel gasadfærd ved stuetemperatur og tryk.
Vigtig note: Selv ideelle gasser kan afvige fra ideel opførsel ved højtryk eller lave temperaturer . Under disse betingelser bliver antagelserne om ubetydelige intermolekylære kræfter og partikelvolumen mindre gyldige.
Sidste artikelHvad er en cool ting ved svovl?
Næste artikelBoblende ammoniak til en opløsning af brominsyre vil producere hvad salt?
 Varme artikler
Varme artikler
-
 At bringe den kulstofreducerende koldsintringsproces ud af laboratorier og ind i keramikfremstillingKredit:University of Warwick En ny teknoøkonomisk analyse, af et hold ledet af en forsker fra WMG ved University of Warwick, viser, at den energiintensive keramiske industri ville opnå både økonom
At bringe den kulstofreducerende koldsintringsproces ud af laboratorier og ind i keramikfremstillingKredit:University of Warwick En ny teknoøkonomisk analyse, af et hold ledet af en forsker fra WMG ved University of Warwick, viser, at den energiintensive keramiske industri ville opnå både økonom -
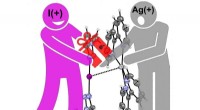 Interaktion mellem iodonium og sølvkation demonstreret for første gangSådan sker det:Positivt jod giver en elektrongave til positivt sølv. Kredit:Antonio Frontera og Kari Rissanen Et internationalt forskerhold ledet af professor Kari Rissanen fra University of Jyvas
Interaktion mellem iodonium og sølvkation demonstreret for første gangSådan sker det:Positivt jod giver en elektrongave til positivt sølv. Kredit:Antonio Frontera og Kari Rissanen Et internationalt forskerhold ledet af professor Kari Rissanen fra University of Jyvas -
 Ny produktion af fullerenkrystal 50 gange hurtigere end forgængeren(a) Foto af produceret FFMP på kvartsplade og (b)-(d) scanningselektronmikroskopbilleder af prøver. Kredit:Yokohama National University Forskere fra Yokohama National University og University of E
Ny produktion af fullerenkrystal 50 gange hurtigere end forgængeren(a) Foto af produceret FFMP på kvartsplade og (b)-(d) scanningselektronmikroskopbilleder af prøver. Kredit:Yokohama National University Forskere fra Yokohama National University og University of E -
 Indtageligt medicinsk udstyr kan brydes ned med lysLet nedbrydelige hydrogeler som dynamiske triggere i GI-enheder. (A) Skematisk af ballonindsættelse og inflation (venstre), nedbrydning via enten en endoskopisk eller usammenhængende LED lyskilde (mid
Indtageligt medicinsk udstyr kan brydes ned med lysLet nedbrydelige hydrogeler som dynamiske triggere i GI-enheder. (A) Skematisk af ballonindsættelse og inflation (venstre), nedbrydning via enten en endoskopisk eller usammenhængende LED lyskilde (mid


