Hvad bestemmer rækkefølgen, i hvilken komponentelementer af binære forbindelser er skrevet?
Sådan fungerer det:
1. Identificer det mere elektronegative element: Elementet med højere elektronegativitet skrives først.
2. Undtagelser for metaller: Metaller er generelt mindre elektronegative end ikke -metaller. Når et metal- og ikke -metal kombineres, skrives metallet først.
3. Almindelige undtagelser: Der er nogle få undtagelser fra denne regel, hovedsageligt på grund af historiske grunde. For eksempel er brint (H) undertiden skrevet først i binære forbindelser, selv når det er mindre elektronegativt end det andet element.
Eksempler:
* NaCl: Chlor (CL) er mere elektronegativ end natrium (NA), så det er skrevet først.
* h₂o: Oxygen (O) er mere elektronegativ end brint (H), men brint skrives først på grund af konvention.
* co₂: Oxygen (O) er mere elektronegativ end kulstof (C), så det er skrevet først.
* fe₂o₃: Oxygen (O) er mere elektronegativ end jern (Fe), men jern skrives først, fordi det er et metal.
Forståelse af elektronegativitet:
* Højere elektronegativitet betyder, at et atom har et stærkere træk på elektroner.
* Den periodiske tendens med elektronegativitet er generelt:
* Øges over en periode (fra venstre til højre).
* Sænker en gruppe (fra top til bund).
Sammenfattende skrives elementet med den højere elektronegativitet normalt først i en binær forbindelse, medmindre forbindelsen involverer et metal, i hvilket tilfælde metallet først skrives.
Sidste artikelHvad er den kemiske formel for olivin?
Næste artikelHvilken type krystallinsk struktur besidder kobolt?
 Varme artikler
Varme artikler
-
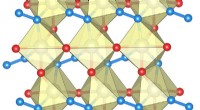 Ekstremt hårdt, men metallisk ledende:Forskere udvikler nyt materiale med højteknologiske udsigterStrukturen af rheniumnitridpernitrid indeholdende enkelte nitrogenatomer (rød) og N-N nitrogenhåndvægte (blå). Større kugler viser rheniumatomer. Kredit:Maxim Byko En international forskergruppe
Ekstremt hårdt, men metallisk ledende:Forskere udvikler nyt materiale med højteknologiske udsigterStrukturen af rheniumnitridpernitrid indeholdende enkelte nitrogenatomer (rød) og N-N nitrogenhåndvægte (blå). Større kugler viser rheniumatomer. Kredit:Maxim Byko En international forskergruppe -
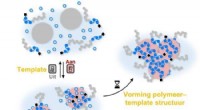 Tænd og sluk for polymeriseringsprocessen ved hjælp af en omskiftelig skabelonKredit:Bas van Ravensteijn Regulering af polymerisationsprocessen er af stor interesse for både industrielle og medicinske anvendelser. I en artikel publiceret i Angewandte Chemie TU/e-forskere vis
Tænd og sluk for polymeriseringsprocessen ved hjælp af en omskiftelig skabelonKredit:Bas van Ravensteijn Regulering af polymerisationsprocessen er af stor interesse for både industrielle og medicinske anvendelser. I en artikel publiceret i Angewandte Chemie TU/e-forskere vis -
 Kontrol af kunstige cilia med magnetfelter og lysFotografi af en række magnetiske cilia foldet og holdt i spidsen af pincet. Kredit:Jessica A.-C. Liu Forskere fra North Carolina State University og Elon University har lavet kunstige cilia, ell
Kontrol af kunstige cilia med magnetfelter og lysFotografi af en række magnetiske cilia foldet og holdt i spidsen af pincet. Kredit:Jessica A.-C. Liu Forskere fra North Carolina State University og Elon University har lavet kunstige cilia, ell -
 Ny bakterie- og algeproces kan hjælpe med at dekarbonisere britisk militærEn ny biologisk ingeniørproces, der kan hjælpe med at dekarbonisere det britiske militær, skal udvikles af forskere ved University of Sheffield. Den banebrydende forskning, ledet af akademikere fra U
Ny bakterie- og algeproces kan hjælpe med at dekarbonisere britisk militærEn ny biologisk ingeniørproces, der kan hjælpe med at dekarbonisere det britiske militær, skal udvikles af forskere ved University of Sheffield. Den banebrydende forskning, ledet af akademikere fra U
- Næsten 120, 000 fordrevne i Myanmar oversvømmelser
- Facebook overvejede opkrævning for adgang til brugerdata
- De yderste elektroner i et atom kaldes elektronskyen?
- Hvad er et år på Jupiter?
- Århundrede gammel fødevaretestmetode opdateret til at omfatte kompleks væskedynamik
- Sådan fungerer kropsdysmorfisk lidelse


