Hvor mange elektroner er der i den udvidede valens for svovldioxid?
1. Lewis -struktur:
* Svovl (er) har 6 valenselektroner.
* Oxygen (O) har 6 valenselektroner.
* Samlede valenselektroner i so₂ =6 + (2 x 6) =18
* Tegn Lewis -strukturen:
* Placer svovl i midten.
* Placer oxygenerne omkring svovl.
* Tilslut hvert ilt til svovl med en enkelt binding (2 elektroner, der deles).
* Fuldfør octets af oxygenerne ved at tilsætte ensomme par (6 elektroner hver).
Du vil bemærke, at svovl nu har 10 elektroner omkring det (2 fra bindingerne og 6 fra ensomme par). Dette er mere end de sædvanlige 8 elektroner til en oktet.
2. Udvidet valens:
* Svovl er i den tredje periode af den periodiske tabel.
* Elementer i tredje periode og videre * kan * have mere end 8 elektroner i deres valensskal på grund af tilgængeligheden af D-orbitaler. Dette kaldes en udvidet valens.
3. Konklusion:
Den udvidede valensskal af svovl i SO₂ har 10 elektroner .
Sidste artikelGasmolekyler er langt fra hinanden i laget?
Næste artikelHvad er massen på 1,36 mol carbon tetrafluorid?
 Varme artikler
Varme artikler
-
 Interstellar kemi:lavtemperaturgasfasedannelse af inden i det interstellare mediumDe enkleste repræsentanter for to-ring PAHer, der bærer to seks-leddede (naphthalen, C10H8; 1) og en seks- sammen med en fem-leddet ring (indene, C9H8; 2). Mens hydrogenabstraktion-vinylacetylen-addit
Interstellar kemi:lavtemperaturgasfasedannelse af inden i det interstellare mediumDe enkleste repræsentanter for to-ring PAHer, der bærer to seks-leddede (naphthalen, C10H8; 1) og en seks- sammen med en fem-leddet ring (indene, C9H8; 2). Mens hydrogenabstraktion-vinylacetylen-addit -
 Forskere skaber bedre materiale til bærbare biosensorerMenneskelig hudstruktur. Kredit:Wikipedia Biosensorer, der kan bæres på menneskelig hud eller sikkert bruges inde i kroppen, er i stigende grad udbredt til både medicinske anvendelser og daglig su
Forskere skaber bedre materiale til bærbare biosensorerMenneskelig hudstruktur. Kredit:Wikipedia Biosensorer, der kan bæres på menneskelig hud eller sikkert bruges inde i kroppen, er i stigende grad udbredt til både medicinske anvendelser og daglig su -
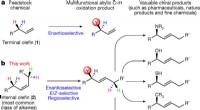 Forskere rapporterer om kemisk reaktion med potentiale til at fremskynde lægemiddeludviklingKatalytisk enantioselektiv oxidation af uaktiverede terminale og interne alkener. Kredit: Natur (2017). DOI:10.1038/nature22805 Kemikere har længe søgt at udvikle nye reaktioner til direkte omdan
Forskere rapporterer om kemisk reaktion med potentiale til at fremskynde lægemiddeludviklingKatalytisk enantioselektiv oxidation af uaktiverede terminale og interne alkener. Kredit: Natur (2017). DOI:10.1038/nature22805 Kemikere har længe søgt at udvikle nye reaktioner til direkte omdan -
 Nær-infrarød sonde afkoder telomerdynamikEn fluorescerende forbindelse blev knyttet til PIPet, der er målrettet mod den gentagne DNA -sekvens, der findes i telomerer. Denne sonde, kaldet SiR-TTet59B, muliggør observation af telomerer i aktio
Nær-infrarød sonde afkoder telomerdynamikEn fluorescerende forbindelse blev knyttet til PIPet, der er målrettet mod den gentagne DNA -sekvens, der findes i telomerer. Denne sonde, kaldet SiR-TTet59B, muliggør observation af telomerer i aktio
- Ingeniørklima:fra paria til frelser?
- Hvad er den nedre del af mantlen og flyder endnu langsommere end rock i atmosfæren?
- Sikker kommunikation med lyspartikler, der omgår afhængigheden af polarisering
- Filippinerne vil indsætte uropoliti for at lukke turister i Boracay
- Hvordan absorberer planter vand fra jorden?
- Radiokilder i galaksehoben ClG 0217+70 inspiceret af astronomer


