I modsætning til natrium og klor bliver nogle atomer mere stabile ved at dele hvad?
Her er hvorfor:
* natrium (NA) og klor (Cl) er begge elementer, der ønsker at opnå en stabil elektronkonfiguration, hvilket betyder at have en fuld ydre skal af elektroner.
* Natrium har en elektron i sin yderste skal, og klor har syv.
* For at opnå stabilitet mister natrium * sin yderste elektron og bliver en positivt ladet ion (Na+).
* Klor * vinder * Denne elektron, der bliver en negativt ladet ion (cl-).
* Disse modsatte ladede ioner tiltrækkes derefter af hinanden og danner en ionisk binding.
Deling af elektroner
* Nogle atomer, især dem i midten af den periodiske tabel, har ikke en stærk tendens til at vinde eller miste elektroner.
* I stedet opnår de stabilitet ved deling af elektroner med andre atomer.
* Denne deling skaber en kovalent obligation , hvor de delte elektroner tiltrækkes af kernerne i begge atomer, der holder dem sammen.
Eksempel:
* ilt (O) har brug for yderligere to elektroner for at fylde sin ydre skal.
* To iltatomer kan dele to elektroner hver og danne en dobbelt kovalent binding (O =O).
* Dette skaber et stabilt molekyle af iltgas.
Sammenfattende, mens nogle atomer opnår stabilitet ved at overføre elektroner (ioniske bindinger), opnår andre stabilitet ved at dele elektroner (kovalente bindinger).
Sidste artikelHvor mange mol KCl er indeholdt i 0,538 L A 2,3 m opløsning?
Næste artikelSymbol og antal elektroner i neutral atom uran?
 Varme artikler
Varme artikler
-
 Teamet bestemmer den første højopløselige struktur af dopaminreceptorenDenne illustration viser den kemiske arkitektur af aminosyrer, der udgør D4 -receptoren bundet til det antipsykotiske lægemiddel nemonaprid (pink). Kredit:UNC / UCSF På den ene eller anden måde, m
Teamet bestemmer den første højopløselige struktur af dopaminreceptorenDenne illustration viser den kemiske arkitektur af aminosyrer, der udgør D4 -receptoren bundet til det antipsykotiske lægemiddel nemonaprid (pink). Kredit:UNC / UCSF På den ene eller anden måde, m -
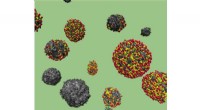 Syntesestudier omdanner affaldssukker til bæredygtige energilagringsapplikationerEn molekylær dynamik-simulering afbilder solide (sort) og hule (flerfarvede) kulstofkugler afledt af affaldssukkerstrømme fra bioraffinaderier. De hule kuglers egenskaber er ideelle til udvikling af e
Syntesestudier omdanner affaldssukker til bæredygtige energilagringsapplikationerEn molekylær dynamik-simulering afbilder solide (sort) og hule (flerfarvede) kulstofkugler afledt af affaldssukkerstrømme fra bioraffinaderier. De hule kuglers egenskaber er ideelle til udvikling af e -
 Innovativ katalytisk reaktion til billig syntese af aromatiske estereKredit:CC0 Public Domain Aromatiske estere er kemikalier, der indeholder en aromatisk ring bestående af funktionelle grupper kaldet estere. Disse organiske forbindelser bruges i vid udstrækning so
Innovativ katalytisk reaktion til billig syntese af aromatiske estereKredit:CC0 Public Domain Aromatiske estere er kemikalier, der indeholder en aromatisk ring bestående af funktionelle grupper kaldet estere. Disse organiske forbindelser bruges i vid udstrækning so -
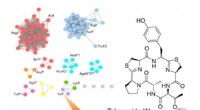 Genomminedrift fører til en ny type peptidprenyleringFigur 1:Målrettet genom -minedrift af prenyltransferaser identificerede TolF -enzymet og tol biosyntetisk genklynge (BGC). Øverst til venstre viser et proteinsekvens -lighednetværk af prenyltransfer
Genomminedrift fører til en ny type peptidprenyleringFigur 1:Målrettet genom -minedrift af prenyltransferaser identificerede TolF -enzymet og tol biosyntetisk genklynge (BGC). Øverst til venstre viser et proteinsekvens -lighednetværk af prenyltransfer
- Høst af vegetation på flodbuffere reducerer næppe fordelene ved vandkvaliteten
- Nyt elektronmikroskop udvider egenskaberne for karakterisering af materialer på laboratoriet
- Hvad gør en ameler i et kredsløb?
- Har Mount Rainier en caldera på sit topmøde?
- Hvad betragtes som et patogen?
- Hvad er formlen for denne kovalente sammensatte dinitrogen -trioxid?


