Teamet bestemmer den første højopløselige struktur af dopaminreceptoren
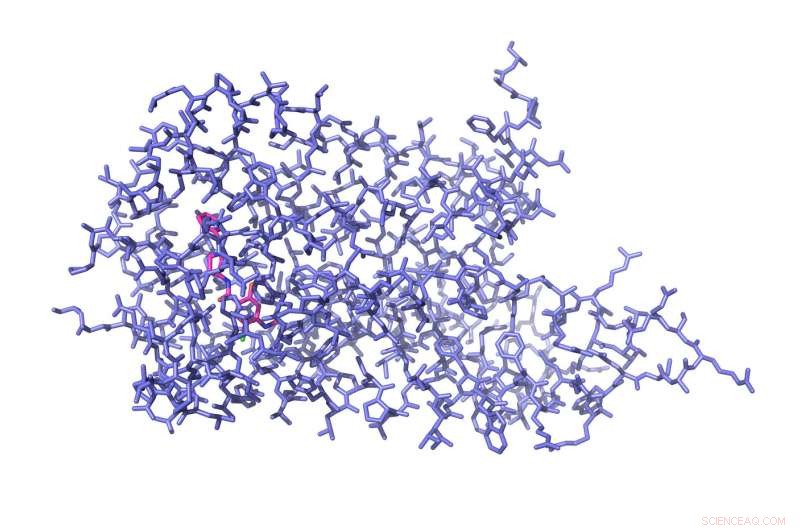
Denne illustration viser den kemiske arkitektur af aminosyrer, der udgør D4 -receptoren bundet til det antipsykotiske lægemiddel nemonaprid (pink). Kredit:UNC / UCSF
På den ene eller anden måde, mange psykiatriske lægemidler virker ved at binde sig til receptormolekyler i hjernen, der er følsomme over for neurotransmitteren dopamin, et kemisk signal, der er centralt for, hvordan vores oplevelser former vores adfærd. Men fordi forskere stadig ikke forstår forskellene mellem de mange slags dopaminreceptorer, der findes på hjerneceller, de fleste af disse lægemidler er "rodet, "binding til flere forskellige dopaminreceptormolekyler og fører til alvorlige bivirkninger lige fra bevægelsesforstyrrelser til patologisk spil.
Nu, forskere ved UC San Francisco, University of North Carolina-Chapel Hill, og Stanford University rapporterer et stort skridt fremad mod at designe mere kraftfulde psykiatriske lægemidler med færre bivirkninger.
Som rapporteret online den 19. oktober, 2017 i Videnskab , holdet har bestemt ("løst" i strukturbiologiens terminologi) krystalstrukturen af en specifik dopaminreceptor kaldet D4 i en utrolig høj opløsning - den højeste for noget dopamin, serotonin, eller epinephrin (aka adrenalin) receptor til dato - så de kan designe en ny forbindelse, der kun binder tæt til D4 og ingen af de andre 320 receptorer, de testede.
Tidligere i år, det samme team løste krystalstrukturen af LSD bundet til en serotoninreceptor for at finde ud af, hvorfor syreture varer så længe, og hvordan man måske justerer stoffet for at være mindre potent.
D4 -dopaminreceptoren har været impliceret i opmærksomhedsunderskud/hyperaktivitetsforstyrrelse (ADHD), kræftmetastase, og endda erektil dysfunktion. Lignende dopaminreceptorsubtyper er afgørende faktorer under tilstande, herunder skizofreni, afhængighed, Alzheimers sygdom, depression, og Parkinsons sygdom. Imidlertid, der er i øjeblikket få specifikke lægemidler til D4 -undertypen, der kan målrette mod den og den alene, hvilket har forhindret forskere i at isolere den specifikke funktion af D4 sammenlignet med andre dopaminreceptorer. Nuværende lægemidler, der er målrettet mod dopaminreceptorer, forårsager også bivirkninger, såsom Parkinsons-lignende bevægelsesforstyrrelser.
"Vi har nu mulighed for at få et krystalklart billede af disse receptorer for at se detaljer som aldrig før, "sagde co-seniorforfatter Bryan L. Roth, MD, Ph.d., Michael Hooker Distinguished Professor of Protein Therapeutics and Translational Proteomics ved UNC School of Medicine. "Det er nøglen. Ved at se disse detaljer fik vi mulighed for at oprette en forbindelse, der kun binder til en slags receptor. Vores ultimative mål er at undgå såkaldte 'scattershot drugs', der rammer mange uønskede receptorer og forårsager alvorlige og potentielt dødelige bivirkninger . "
Brian Shoichet, Ph.d., co-senior forfatter og professor i farmaceutisk kemi i UCSF's School of Pharmacy, sagde, "Vores beregningsmodelleringskapacitet gav os mulighed for praktisk talt at skærme over 600, 000 forbindelser meget hurtigere end traditionelle screeningsmetoder og skaber et hierarki af forbindelser, der potentielt kun binder til D4 -dopaminreceptoren. Vores arbejde med at skabe bedre lægemidler er langt fra slut, men de computerbaserede screeningsværktøjer, der bruges her, er ved at blive et stadig mere pålideligt værktøj i vores arsenal. "
Samarbejdspartnere knækker sagen ved hjælp af krystaller og computere
Dopaminreceptorer er en del af en stor familie af molekyler kaldet G-proteinkoblede receptorer, eller GPCR'er, som er de tilsigtede mål for cirka 35 procent af alle lægemidler på markedet. På trods af deres betydning, meget lidt er kendt om strukturerne i langt de fleste GPCR'er, herunder D4 og andre dopaminreceptorer, gør det udfordrende at designe mere præcise lægemidler med færre bivirkninger.
Typisk, forskere har løst den kemiske struktur af proteiner ved hjælp af en teknik kaldet røntgenkrystallografi:de får proteinet til at kondensere til et tæt pakket krystalgitter, derefter skyde røntgenstråler på krystallen og kan beregne proteinets struktur ud fra de resulterende diffraktionsmønstre. Imidlertid, at få D4 -proteinet til at krystallisere med et lægemiddel bundet til det - for at fastslå receptorens virkningssted - havde vist sig at være en uløst udfordring.
For at løse højopløsningsstrukturen i D4, Roth lab postdocs Sheng Wang, Ph.d., og Daniel Wacker, Ph.d., - to af tre første forfattere - gennemførte en række intense eksperimenter over tre år for at få D4 -receptoren til at krystallisere. De opløste receptormolekyler i vandbaserede buffere og fjernede derefter langsomt vandet. Derefter, for at være sikker på, at receptorerne sad helt stille, så de kunne afbildes, Wang og Wacker anvendte en række eksperimentelle tricks - beskrevet i Videnskab papir - for omhyggeligt at trække vand ud ved de helt rigtige forhold, indtil receptorerne blev pakket tæt ind i krystaller, der derefter kunne bombarderes med røntgenstråler. Resultatet var det første nogensinde superhøjopløselige billede af den kemiske arkitektur af D4 bundet til det antipsykotiske lægemiddel nemonaprid.
"Vi var nødt til at få en struktur i høj opløsning som denne, så vi kunne se præcis, hvordan en forbindelse kan binde til D4, "Sagde Wang." Det er som at se detaljer på et fotografi, som du bare ikke kunne se, medmindre billedet var i superhøj opløsning. Når vi havde det, Vi gik sammen med vores UCSF -kolleger om computermæssigt at screene efter forbindelser, der muligvis kan binde til denne receptor, men ikke andre. "
Anat Levit, Ph.d., en postdoc i Shoichets laboratorium ved UCSF og den tredje co-første forfatter, ledet beregningsmodelleringen og opdagelsen af nye sammensatte i samarbejde med medforfatter Ron Dror, Ph.d., og hans Stanford lab.
"Teoretisk set der er et næsten uendeligt antal kemiske forbindelser, der kan laves, og dette kemiske rum er enormt og stort set uudforsket. Imidlertid, vi har store biblioteker med virtuelle forbindelser, der i det mindste kommer ind i dette rum, "Sagde Levit." Ved hjælp af den nye struktur i høj opløsning og vores beregningsmodelleringsprogram, vi passer hver til 600, 000 virtuelle forbindelser ind i dopamin/nemonaprid -bindingsstedet for D4 -receptoren, som du måske passer kandidatpuslespil ind i et delvist konstrueret puslespil. "
Levit og kolleger i Shoichet -laboratoriet vurderede alle 600, 000 af disse kemiske "puslespil" for at se, hvor godt de passer ind i den fulde D4 -receptor, som Roth lab -teamet havde løst. Når de havde identificeret de ti kandidatforbindelser, som computermodellering pegede på som sandsynlige bindende partnere med D4 -receptoren, de sendte dem tilbage til Wang og Wacker for at teste eksperimentelt i laboratoriet.
Roth lab -teamet fandt ud af, at to af forbindelserne faktisk passer ind i D4 -receptoren, men gjorde det relativt løst.
"De to første forbindelser var bare udgangspunkt, "Sagde Wacker." Et lægemiddel eller endda en 'sonde', der bruges til at undersøge receptorens biologi, skal passe tæt til receptoren. En forbindelse skal forblive vedhæftet i en periode for at have en effekt inde i cellen. "
Forskningen sprang derefter frem og tilbage mellem computermodellerne ved UCSF og forsøgslaboratoriet ved UNC-Chapel Hill for at designe og teste snesevis af nye kemiske forbindelser, der kan binde tættere til D4-receptoren.
Endelig, ved at pille ved kemiske forbindelser og ioniske attraktioner her, tilføjelse af nye kemiske grupper der, Levit identificerede en virtuel forbindelse - forbindelse UCSF924 - som computersimuleringer foreslog kunne binde ekstremt tæt til D4 -receptoren. Ved test af denne forbindelse i laboratoriet, Wang bekræftede, at molekylet kunne binde til D4-receptoren 1000 gange kraftigere end de første virtuelle forbindelser.
D4-specifik forbindelse vil hjælpe forskere med at forstå, og en dag medicin, specifikke dopaminreceptorer
Forskerne planlægger nu at teste deres nye forbindelse i dyremodeller for at bestemme præcis, hvordan den aktiverer D4 -receptoren, og hvordan aktivering af D4 -receptoren alene ændrer hjernens funktion.
"Ingen ved, hvad D4 -receptoren præcist gør, "Sagde Wang." Den nye sammensætnings høje specificitet og høje styrke vil gøre det muligt for os at begynde at løse dette for første gang. "
Teamet planlægger også at bruge den meget selektive UCSF924-forbindelse til at lære flere detaljer om, hvordan eksisterende lægemidler virker ved at ændre specifikke cellulære veje inde i celler.
"Dette arbejde har konsekvenser ud over D4, "Sagde Wacker." For eksempel, antipsykotika er beskidte stoffer; de ramte alt. For bedre at forstå dem og forbedre dem, vi skal forstå, hvad de gør ved hvert eneste mål, de rammer. Vores arbejde er et vigtigt skridt i retning af det mål. "
Shoichet tilføjede, "Mens UCSF924 langt fra er et lægemiddel, det er en stor sonde, og vi gør det åbent tilgængeligt for samfundet via Sigma-Aldrich, som SML2022. "
Når jeg ser tilbage på fremskridt på dette område, Shoichet sagde, "Da struktur- og computerbaserede skærme først blev udviklet på UCSF for 30 år siden, tanken om, at vi ville have så smukke syn på lægemiddelmål, der er lige så afgørende og subtile som dopamin D4 -receptoren, og at vi kunne udnytte det så hurtigt og effektivt, var langt fra nogens sind. Men National Institutes of Health investerede i disse forskningsområder i årtier. Nu begynder den langsigtede forskningsindsats at betale sig i evnen til beregningsmæssigt at screene nye GPCR-mål og finde nye og spændende kemiske leads til biologi og til opdagelse af lægemidler. "
 Varme artikler
Varme artikler
-
 Ser komplekse molekyler på arbejdeRhodopsin før (venstre) og efter aktivering af lys (højre):Aktiveringen forårsager ændringer i funktionelle grupper inde i molekylet (forstørrelsesglas), som påvirker hele molekylet. Kredit:E. Ritter/
Ser komplekse molekyler på arbejdeRhodopsin før (venstre) og efter aktivering af lys (højre):Aktiveringen forårsager ændringer i funktionelle grupper inde i molekylet (forstørrelsesglas), som påvirker hele molekylet. Kredit:E. Ritter/ -
 Selvhelbredende katalysatorer gør det lettere at lagre solenergi med vandSelvsamlingsvejen, der bruges til selvhelbredende katalysatorer. Kredit:Costentin et al. ©2017 PNAS (Phys.org) – I øjeblikket er en af de mest effektive måder at lagre solenergi på at overføre e
Selvhelbredende katalysatorer gør det lettere at lagre solenergi med vandSelvsamlingsvejen, der bruges til selvhelbredende katalysatorer. Kredit:Costentin et al. ©2017 PNAS (Phys.org) – I øjeblikket er en af de mest effektive måder at lagre solenergi på at overføre e -
 Et isbjørn-inspireret materiale til varmeisoleringElektronmikroskopi af det hule bioinspirerede carbonrør aerogel. Kredit:Hui-Juan Zhan For isbjørne, isoleringen fra deres fedt, hud, og pels er et spørgsmål om overlevelse i det frigide Arktis. Fo
Et isbjørn-inspireret materiale til varmeisoleringElektronmikroskopi af det hule bioinspirerede carbonrør aerogel. Kredit:Hui-Juan Zhan For isbjørne, isoleringen fra deres fedt, hud, og pels er et spørgsmål om overlevelse i det frigide Arktis. Fo -
 Hvordan absorberer papirhåndklæder?Ser man på den måde, hvorpå vand holdes inde i en stiv, hård beholder, såsom en skål eller en kop, kan det være forvirrende at prøve at finde ud af, hvordan en porøs, blød genstand som en svamp, klud
Hvordan absorberer papirhåndklæder?Ser man på den måde, hvorpå vand holdes inde i en stiv, hård beholder, såsom en skål eller en kop, kan det være forvirrende at prøve at finde ud af, hvordan en porøs, blød genstand som en svamp, klud
- Sjældent element til at levere bedre materiale til højhastighedselektronik
- Undersøgelse blandt universitetsstuderende viser, at 39,2 % sender seksuelt indhold via mobiltelefo…
- Unikke olieædende bakterier fundet i verdens dybeste havgrav
- Fryseramme:Forskere løser, hvordan celler folder proteiner ud
- Dobbeltpolarisationsradarer til forudsigelse af kraftig nedbør i Kina:Forskning og udvikling
- Effektive måder at genbruge og reducere ikke-biologisk nedbrydeligt affald


