Hvordan bliver et svovlatom ion?
Forståelse af svovls egenskaber
* Elektronkonfiguration: Svovl har 16 elektroner med følgende konfiguration:2-8-6. Dette betyder, at det har 6 elektroner i sin yderste skal (Valence Shell).
* octet regel: Atomer stræber efter at have en fuld ydre skal af 8 elektroner (Octet). Dette gør dem mere stabile.
danner en ion
Svovl kan blive en ion på to måder:
* at vinde elektroner (anion): Den mest almindelige måde for svovl at danne en ion er ved at vinde to elektroner. Dette fylder sin ydre skal og opnå den stabile oktetkonfiguration.
* taber elektroner (kation): Det er mindre almindeligt, men svovl kan også miste elektroner for at danne en kation. Dette er mindre sandsynligt, fordi det kræver en masse energi for at overvinde den stærke tiltrækning af kernen til dens valenselektroner.
svovlanionen (s²⁻)
* proces: Svovl får to elektroner til at blive S²⁻. Dette skyldes, at det at vinde to elektroner gør sin ydre skal komplet (2-8-8) og dermed mere stabil.
* opladning: Den negative ladning kommer fra de to ekstra elektroner. Hver elektron har en negativ ladning, og svovl har nu to mere end sin neutrale tilstand.
svovlkationen (S⁴⁺, S⁶⁺)
* proces: I meget specifikke situationer kan svovl miste 4 eller 6 elektroner til dannelse af henholdsvis S⁴⁺ eller S⁶⁺. Disse ioner er meget reaktive og ustabile.
Nøglepunkter
* iondannelse: Processen med at blive en ion kaldes ionisering.
* stabilitet: Iondannelse sigter mod at opnå en mere stabil elektronkonfiguration (normalt en fuld ydre skal).
* ioniske forbindelser: Ioner kombineres ofte for at danne ioniske forbindelser. For eksempel danner svovl normalt en ionisk forbindelse med metaller, såsom natriumsulfid (Na₂s).
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse punkter!
Sidste artikelHvem er mere polær H2O eller HCL?
Næste artikelHvad er antallet af protoner elektroner og neutroner i et atomchlor 37?
 Varme artikler
Varme artikler
-
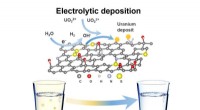 Brug af grafenskum til at filtrere toksiner fra drikkevandEt genanvendeligt 3D-funktionaliseret reduceret grafenoxidskum (3D-FrGOF) bruges som en in situ elektrolytisk aflejringselektrode til at udvinde uran fra forurenet vand. Kredit:MIT Nogle former fo
Brug af grafenskum til at filtrere toksiner fra drikkevandEt genanvendeligt 3D-funktionaliseret reduceret grafenoxidskum (3D-FrGOF) bruges som en in situ elektrolytisk aflejringselektrode til at udvinde uran fra forurenet vand. Kredit:MIT Nogle former fo -
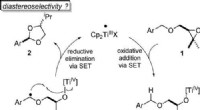 Forskere udvikler en bæredygtig katalyseprocesAtomøkonomisk omdannelse af benzylethere til acetaler ved titanocen(III)-katalyse i enkeltelektrontrin (SET). Angewandte Chemie, DOI:10.1002/anie.202013561 Acetaler er vigtige kemiske forbindelser
Forskere udvikler en bæredygtig katalyseprocesAtomøkonomisk omdannelse af benzylethere til acetaler ved titanocen(III)-katalyse i enkeltelektrontrin (SET). Angewandte Chemie, DOI:10.1002/anie.202013561 Acetaler er vigtige kemiske forbindelser -
 Opdagelse kan fjerne mikropollutanter fra miljøetDr. Rong Ye (til venstre), Dr. Ming Zhao (i midten), og Dr. Peng Cheng (til højre) i Cornell diskuterer deres hærfinansierede forskning, der identificerer en ny kemitilgang, der kan fjerne mikropollut
Opdagelse kan fjerne mikropollutanter fra miljøetDr. Rong Ye (til venstre), Dr. Ming Zhao (i midten), og Dr. Peng Cheng (til højre) i Cornell diskuterer deres hærfinansierede forskning, der identificerer en ny kemitilgang, der kan fjerne mikropollut -
 Metode til at forudsige lægemiddelstabilitet kan føre til mere effektive lægemidlerKredit:Gatis Gribusts/Flickr Forskere fra Storbritannien og Danmark har udviklet en ny metode til at forudsige den fysiske stabilitet af lægemiddelkandidater, som kunne hjælpe med udviklingen af
Metode til at forudsige lægemiddelstabilitet kan føre til mere effektive lægemidlerKredit:Gatis Gribusts/Flickr Forskere fra Storbritannien og Danmark har udviklet en ny metode til at forudsige den fysiske stabilitet af lægemiddelkandidater, som kunne hjælpe med udviklingen af
- Hvilken gas produceres, når en alkohol reagerer med PCL3?
- Hvordan fortæller man, hvor gammelt et fossil er ved klippelaget?
- Hvorfor bruger folk vindkraft?
- Kan ekstrem afsmeltning destabilisere iskapperne?
- Er kridt mindre tæt end saltvand?
- Hvad er forholdet mellem masse af materiale og mængde varme, det kan overføre?


