Forbedrede Bohr sig med atomteori?
* Rutherfords model: Rutherfords model var primært baseret på hans guldfolieeksperiment, som etablerede eksistensen af en tæt, positivt ladet kerne i midten af et atom. Imidlertid kunne det ikke forklare, hvorfor elektroner ikke spiral ind i kernen på grund af elektrostatisk tiltrækning, og hvorfor atomer udsender specifikke bølgelængder af lys.
* Bohrs bidrag:
* Kvantiserede energiniveau: Bohr foreslog, at elektroner kun kan optage specifikke energiniveauer inden for et atom, svarende til trin på en stige. Dette koncept, kaldet kvantisering behandlede direkte spørgsmålet om elektroner, der ikke spiraliseres ind i kernen.
* Elektronovergange: Bohr forklarede, at når en elektron hopper fra et højere energiniveau til et lavere, udsender den en foton af lys med en specifik energi svarende til forskellen mellem de to niveauer. Dette forklarede de observerede linjespektre for atomer.
* atomspektre: Bohrs model forklarede med succes emissions- og absorptionsspektre for brint og andre enkle atomer, som Rutherfords model ikke kunne redegøre for.
* Planetarisk model: Bohr visualiserede elektroner, der kredser om kernen i specifikke cirkulære kredsløb, ligesom planeter, der drejer sig om solen.
Begrænsninger af Bohrs model:
Mens Bohrs model var en stor fremgang, havde den begrænsninger:
* Det kunne ikke forklare spektrene for mere komplekse atomer.
* Det kunne ikke forklare den fine struktur af spektrale linjer.
* Det kunne ikke nøjagtigt forudsige opførsel af elektroner i atomer.
De næste trin:
Bohrs arbejde banede vejen for udviklingen af mere sofistikerede kvantemekaniske modeller af atomet, såsom Schrödinger -modellen, som gav et mere nøjagtigt og komplet billede af atomstruktur og opførsel.
Sammenfattende var Bohrs model en betydelig forbedring i forhold til Rutherfords model, men den blev i sidste ende erstattet af kvantemekanik. Ikke desto mindre var hans bidrag afgørende i udviklingen af vores forståelse af atomet.
 Varme artikler
Varme artikler
-
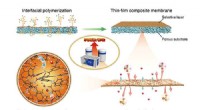 Forskere gør gennembrud inden for ionledende kompositmembranerFremstillingen og funktionen af tyndfilmskompositmembranen. Kredit:DAI Qing Kinesiske forskere under ledelse af Profs. Li Xianfeng og Zhang Huamin fra Dalian Institute of Chemical Physics (DICP)
Forskere gør gennembrud inden for ionledende kompositmembranerFremstillingen og funktionen af tyndfilmskompositmembranen. Kredit:DAI Qing Kinesiske forskere under ledelse af Profs. Li Xianfeng og Zhang Huamin fra Dalian Institute of Chemical Physics (DICP) -
 Ny metode lover færre bivirkninger fra kræftmedicinHis-tag acylering kan præcist målrette komplekse garnlignende proteinstrukturer og gør det også muligt at producere lægemidler med helt nye egenskaber. Kredit:Pexels Proteinforskning er et af de h
Ny metode lover færre bivirkninger fra kræftmedicinHis-tag acylering kan præcist målrette komplekse garnlignende proteinstrukturer og gør det også muligt at producere lægemidler med helt nye egenskaber. Kredit:Pexels Proteinforskning er et af de h -
 Den perfekte blanding:Optimering af gasblandinger til brintlagring i clathrathydraterForskere finder optimal hydrogen-naturgasblanding til at fange brint i burlignende molekyler mere effektivt. Kredit:GIST I vores igangværende søgen efter at forvandle sig til et mere miljøvenligt
Den perfekte blanding:Optimering af gasblandinger til brintlagring i clathrathydraterForskere finder optimal hydrogen-naturgasblanding til at fange brint i burlignende molekyler mere effektivt. Kredit:GIST I vores igangværende søgen efter at forvandle sig til et mere miljøvenligt -
 Antimalariamedicin tilbyder et smørbord af nye herbiciderKredit:University of Western Australia Et hold af plantebiologer og kemikere fra University of Western Australia i samarbejde med personale fra kemivirksomheden BASF har brugt det overraskende tæt
Antimalariamedicin tilbyder et smørbord af nye herbiciderKredit:University of Western Australia Et hold af plantebiologer og kemikere fra University of Western Australia i samarbejde med personale fra kemivirksomheden BASF har brugt det overraskende tæt
- Undersøgelse identificerer reaktionsbetingelser, der kan gøre autooxidation af aldehyder mere milj…
- Stor miljøudfordring, da mikroplast skader vores drikkevand
- GRACE-FO:Knækker en kold sag
- Hvor mange tektoniske plader er kun lavet af oceanisk skorpe?
- Hvad er sløjfer af stof, der strømmer fra solen?
- Hvad er videnskabsdefinitionslederen?


