Hvorfor kuldioxid er en gas ved stuetemperatur, mens jod fast temperatur?
kuldioxid (CO2)
* svage intermolekylære kræfter: CO2 er et lineært molekyle med en symmetrisk fordeling af elektroner. Dette betyder, at det har meget svage London -spredningskræfter, den eneste type intermolekylær kraft, der er til stede. Disse kræfter er midlertidige, flygtige attraktioner, der opstår som følge af udsving i elektronfordeling.
* lav molekylvægt: Den relativt lave molekylvægt af CO2 bidrager yderligere til svagheden ved de intermolekylære kræfter.
jod (i2)
* stærkere intermolekylære kræfter: Jod er et diatomisk molekyle med en større elektronsky end CO2. Dette fører til stærkere London -spredningskræfter på grund af den større polariserbarhed af iodatomerne.
* Højere molekylvægt: Jodens højere molekylvægt bidrager også til stærkere intermolekylære kræfter.
Konklusion
De svage intermolekylære kræfter i CO2 overvindes let af den termiske energi, der er til stede ved stuetemperatur, så den kan eksistere som en gas. I modsætning hertil er de stærkere intermolekylære kræfter i jod tilstrækkelige til at holde molekylerne sammen i en fast tilstand ved stuetemperatur.
Yderligere note:
Mens forklaringen ovenfor fokuserer på London -spredningskræfter, er det værd at bemærke, at der er andre faktorer, der kan påvirke stoftilstanden, såsom:
* molekylær geometri: En mere kompleks molekylær form kan føre til yderligere typer intermolekylære kræfter, såsom dipol-dipol-interaktioner.
* Polaritet: Polære molekyler (med permanente dipoler) har en tendens til at have stærkere intermolekylære kræfter end ikke -polære molekyler.
I tilfælde af CO2 og Jod er den primære faktor, der driver forskellen i fysisk tilstand, den relative styrke af London -spredningskræfter.
Sidste artikelKemisk reaktion mellem phenol og bromvand?
Næste artikelHvad er volumenet på 72,0 gram svovldioxid?
 Varme artikler
Varme artikler
-
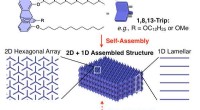 Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles
Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles -
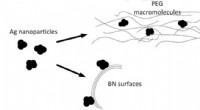 Bornitrid og sølv nanopartikler for at hjælpe med at slippe af med kulilte-emissionerSkemaet med at syntetisere nanohybridkatalysatoren fra lagdelt bornitrid, sølv nanopartikler, og polyethylenglycol. Kredit:Anton S. Konopatsky et al./ Journal of Catalysis , 2018 Russiske kemike
Bornitrid og sølv nanopartikler for at hjælpe med at slippe af med kulilte-emissionerSkemaet med at syntetisere nanohybridkatalysatoren fra lagdelt bornitrid, sølv nanopartikler, og polyethylenglycol. Kredit:Anton S. Konopatsky et al./ Journal of Catalysis , 2018 Russiske kemike -
 Ny metode til at vurdere komforten af smarte og funktionelle tekstilerKredit:CC0 Public Domain Indtil nu, brugervenlighed har været i fokus i udviklingen af smarte og funktionelle tekstiler. Nu er det tid til at tage fat på komforten, når du bærer disse tekstiler
Ny metode til at vurdere komforten af smarte og funktionelle tekstilerKredit:CC0 Public Domain Indtil nu, brugervenlighed har været i fokus i udviklingen af smarte og funktionelle tekstiler. Nu er det tid til at tage fat på komforten, når du bærer disse tekstiler -
 Skibe glider i en luftkuvertKomplekse biomimetiske strukturer bevarer luften under vand. Luften på den faktisk blå bærer fremstår sølvfarvet under vand. Kredit:Thomas Schimmel, SÆT Friktion, korrosion, og biofilm er tre stor
Skibe glider i en luftkuvertKomplekse biomimetiske strukturer bevarer luften under vand. Luften på den faktisk blå bærer fremstår sølvfarvet under vand. Kredit:Thomas Schimmel, SÆT Friktion, korrosion, og biofilm er tre stor
- Ender alle baser med hydroxid?
- Mauna Loa Fakta for Kids
- Hvilken gruppe af genetiske muskelsygdomme forårsager progressiv svaghed og degeneration af skeletm…
- Sådan får du gratis CDL-uddannelse
- Når en forlængerfjeder lagrer den mest elastiske energi, når den er i hvilken position?
- Hvad er de typer fordampning og dens definition?


